Warum entladen sich Lithium-Ionen-Akkus mit der Zeit – selbst wenn sie nicht in Gebrauch sind? Dahinter steckt ein verblüffend simpler Grund, wie nun Forscher entdeckt haben: Die aufgerollten Elektroden dieser Batterien werden mit einfachem PET-Klebeband zusammengehalten. Wenn der Akku jedoch warm wird, wird dieser Allerweltskunststoff zu Dimethyl-Terephthalat (DMT) zersetzt – und dieses Molekül wirkt wie ein elektrochemisches Shuttle, das die Batterie entlädt.
Lithium-Ionen-Akkus sind die wichtigsten Stromlieferanten für mobile Technik – vom Handy über den Laptop bis zum Elektroauto. Ihre hohe Energiedichte, das vergleichsweise geringe Gewicht und die lange Haltbarkeit machen diese Batterien nahezu unverzichtbar. Allerdings sind auch sie nicht perfekt: Nach längerem Gebrauch führen Lithiumablagerungen zu einem schleichenden Leistungsverlust und wenn sie zu heiß werden, können Lithium-Akkus sogar explodieren.
Was ist der Grund für die Selbstentladung?
Und noch ein Problem gibt es, das fast jeder schon im Alltag erlebt hat: Selbst wenn Lithium-Ionen-Akkus gar nicht in Gebrauch sind, verlieren sie mit der Zeit ihre Ladung. Schon länger vermuten Wissenschaftler, dass ein sogenanntes Redox-Shuttle an dieser Selbstentladung schuld ist. Dabei handelt es sich um ein elektrochemisch aktives Molekül, das an der Kathode des Akkus reduziert wird und dabei ein Elektron aufnimmt. Dann wandert es zur Anode und wird dort durch unter Elektronenabgabe wieder oxidiert.
„Für jedes Elektron, das auf diese Weise von der negativen zur positiven Elektrode transportiert wird, bewegt sich auch ein Lithium-Ion dorthin und verursacht so die Selbstentladung“, erklären Sebastian Buechele von der Dalhousie University im kanadischen Halifax und seine Kollegen. Doch welches Molekül steckt dahinter? Und woher kommt das molekulare Shuttle in den Lithium-Ionen-Akkus?
Verfärbter Elektrolyt
Um das zu klären, haben Buechele und sein Team verschiedene Bautypen von Lithium-Ionen-Akkus noch einmal genau untersucht, darunter auch die in Elektroautos, Laptops und anderen Mobilgeräten verbauten NMC-Akkus. Dafür setzten sie die Batterien verschiedenen Temperaturen aus, nahmen sie auseinander und prüften ihre chemische Zusammensetzung und das elektrochemische Verhalten der einzelnen Komponenten.
Dabei zeigte sich: Als die Akkus warm wurden, verfärbte sich ihr normalerweise farbloser Elektrolyt immer stärker. Bei mehr als 25 Grad wurde er leicht gelblich, dann orange und bei 70 Grad schließlich intensiv dunkelrot. Gleichzeitig deuteten die elektrochemischen Messungen auf einen aktiven Redox-Prozess in den Akkus hin. Welches Molekül dafür verantwortlich war, konnte das Team dann durch chemische Analysen unter anderem mithilfe der Gaschromatografie-Massenspektrometrie klären.
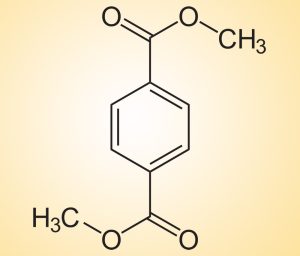
Grundeinheit des PET-Kunststoffs als Übeltäter
Das überraschende Ergebnis: „Unseren Experimenten zufolge kommt nur Dimethyl-Terephthalat (DMT) als potenzielles Redox-Shuttle in den Elektrolyten in Frage“, berichten Buechele und seine Kollegen. Diese organische Verbindung mit einem Benzolring ist jedoch nichts anderes als die Grundeinheit des Allerweltkunststoffs PET (Polyethylen-Terephthalat). Das ladungsraubende Shuttle-Molekül ist demnach eine Komponente des Kunststoffs, das in Plastikflaschen und unzähligen Alltagsobjekten vorkommt.
Doch wie kommt dieses Plastik in die Lithium-Ionen-Akkus? Teil der aktiven Akku-Komponenten ist der PET-Kunststoff nicht. Doch in gängigen Batteriezellen wird ein Klebeband verwendet, um die eng aufgerollten Elektrodenschichten zusammenzuhalten – und dieses Klebeband besteht aus PET. „Das hätten wir nie erwartet, weil niemand auf diese inaktiven Komponenten achtet“, sagt Seniorautor Michael Metzger von der Dalhousie University. „Aber es ist die chemische Zersetzung dieses Klebebands, die das Redox-Shuttle-Molekül erzeugt.“
Simples Klebeband, große Bedeutung
Ein simples Klebeband ist demnach schuld daran, dass Lithium-Ionen-Akkus sich im Laufe der Zeit selbst entladen. Sobald die Batterie sich ein wenig erwärmt, setzen chemische Reaktionen ein, die den Kunststoff angreifen und in seine Grundeinheiten zerlegen. Das freigesetzte Dimethyl-Terephthalat wird dann zum elektrochemischen Shuttle, das nach und nach den Akku entlädt.
„Das ist eine kommerziell bedeutsame Entdeckung“, sagt Metzger. Denn dank dieses Wissens lässt sich das Entladungsproblem nun beheben. Ersetzt man das PET-Klebeband durch ein anderes, weniger anfälliges Material, entsteht auch kein entladendes DMT. „Es ist eine kleine Sache, aber es kann definitiv dabei helfen, Akkus besser zu machen“, so der Forscher. Das Team ist bereits in Kontakt mit Akkuherstellern.
„Die Selbstentladung ist ein wichtiges Thema für sie“, sagt Metzger. „Einer der Ingenieure sagte zu mir: Ich habe gehört, dass ihr Jungs ein Problem mit dem PET-Klebeband entdeckt habt‘. Ich erklärte ihm daraufhin, dass dies die Ursache für die Selbstentladung ist, und fragte ihn, was sie in ihren Akkuzellen nutzen. Die Antwort war: PET-Band.“ (Journal of The Electrochemical Society, 2023; doi: 10.1149/1945-7111/acaf44)
Quelle: Dalhousie University













