Aggressiver Helfer: Chemiker haben eine neue Gruppe von sogenannten Lewis-Supersäuren erzeugt – hochreaktive Säuren, die anderen Molekülen Elektronen entreißen und dadurch auch starke Bindungen aufbrechen können. Die neuen Supersäuren in Form von Boronsäureestern und Ferrocenyl-Boranen enthalten Bor, Eisen und aromatische Kohlenwasserstoffringe und lassen sich elektrochemisch herstellen. Sie könnten künftig dabei helfen, schwerabbaubare organische Schadstoffe zu knacken und in nutzbare Chemierohstoffe umzuwandeln.
Chemische Bindungen entstehen, wenn Atome einige ihrer Außenelektronen teilen oder ganz an den Bindungspartner abgeben. Die Festigkeit dieser Bindungen entscheidet unter anderem darüber, wie stabil ein Molekül ist und wie leicht es beispielsweise in der Umwelt wieder abgebaut werden kann. Auch die Synthese neuer Substanzen aus molekularen Ausgangsstoffen wird durch zu feste Bindungen erschwert.
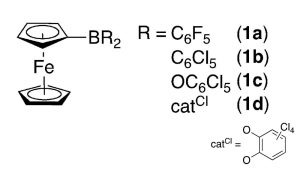
Bindungsbruch durch Elektronenklau
In solchen Fällen setzen Chemiker oft sogenannte Lewis-Säuren als Katalysatoren ein. Diese hochreaktiven Säuren können anderen Molekülen Elektronenpaare entreißen und so auch stabile Bindungen aufbrechen. Als stärkste Lewis-Säure galt lange Antimonpentafluorid (SbF5), inzwischen haben Chemiker jedoch einige phosphor- und borhaltige organische Verbindungen entdeckt, die noch aggressiver sind. Sie werden daher als Lewis-Supersäuren bezeichnet.
„Für starke Bindungen benötigt man sehr reaktive Reagenzien, also Stoffe, die extrem bereitwillig reagieren“, erklärt Seniorautor Jan Paradies von der Universität Paderborn. Allerdings lassen sich solche Lewis-Supersäuren wegen ihrer hohen Reaktivität nur sehr schwer synthetisieren und isolieren. Mithilfe elektrochemischer Methoden ist es den Chemikern nun jedoch gelungen, eine neue Gruppe dieser Supersäuren herzustellen. „Durch einen Trick haben wir es geschafft, solche Moleküle herzustellen und in katalytischen Reaktionen einzusetzen“, sagt Paradies.














