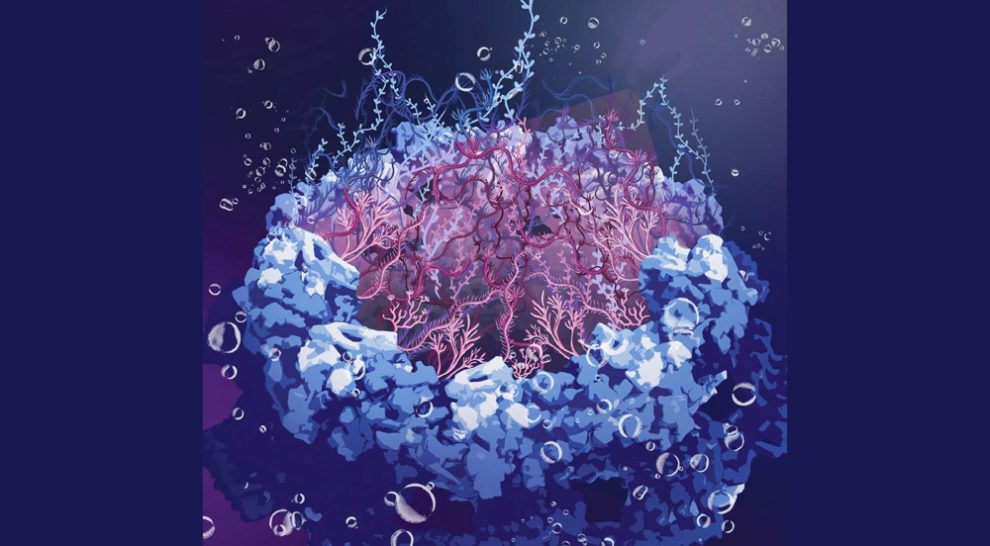
Schutz für unsere DNA: Forschende haben erstmals die Struktur der Kernporen in unseren Zellkernen entschlüsselt – der Öffnungen, die für die Funktion und den Schutz unserer DNA entscheidend sind. Demnach wird der Zugang zum Zellkern von einem beweglichen Kranz aus Proteinfäden geschützt. Diese spaghettiähnlich ungeordneten Fäden lassen nur entsprechend „etikettierte“ Moleküle durch, wehren aber Viren und Schadstoffe ab, wie das Team in „Nature“ berichtet.
Unser genetisches Erbmaterial ist im Zellkern verstaut und durch die Kernmembran vom Rest der Zelle getrennt. Damit Botenstoffe, RNA und Stoffwechselprodukte dennoch in den Kern hinein- oder hinauskommen, sind rund 2.000 Poren in die Kernmembran eingebaut, die aus jeweils etwa 1.000 Proteinen bestehen. Die Kernporen agieren als molekulare Türsteher: Sie lassen für die Zellfunktion wichtige Moleküle durch und sperren Krankheitserreger oder Giftstoffe aus. Das Pensum dieser molekularen Wächter ist dabei enorm: Sie müssen im Schnitt mehrere zehntausend „Besucher“ pro Minute kontrollieren.
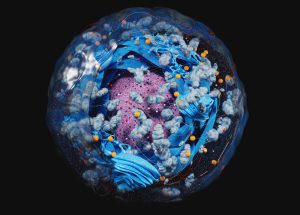
Poren mit Fangarmen
Doch wie schaffen die Kernporen diese Mammutaufgabe? Diese Frage beschäftigt Wissenschaftler schon seit Jahrzehnten. Es gab bereits erste Hinweise darauf, dass am Gerüst der Kernpore zahlreiche Proteine befestigt sind, die wie Fangarme tief in die zentrale Öffnung hineinragen. „Diese FG-Nucleoporine (FG-NUP) bilden eine permeable Barriere im Zentralkanal der Kernpore, die die Passage großer Frachten blockiert, sofern diese nicht eine bestimmte Erkennungssequenz präsentieren“, erklären Miao Yu von der Universität Mainz und ihre Kollegen.
Wie diese Protein-Tentakel aber angeordnet sind und wie sie Eindringlinge abblocken, blieb unklar. Denn diese Porenproteine bestehen aus ungeordneten Sequenzen ohne feste dreidimensionale Faltung und Struktur. Sie bewegen sich ständig und verändern flexibel ihre Form – wie Spaghetti im kochenden Wasser. Genau darin liegt das Problem: Die meisten Techniken zur Analyse und Abbildung von Proteinen funktionieren nur mit einer stabilen, geordneten 3D-Struktur, die die intrinsisch ungeordneten Kernporen-Proteine (IDP) aber nicht haben.
„Deshalb wurde die aus FG-NUPs bestehende Transportmaschinerie selbst in hochaufgelösten Tomografien oder mittels KI errechneten Strukturmodellen nur als rund 60 Nanometer großes Loch dargestellt“, erklären die Forschenden.
Erster Blick auf Protein-Tentakel
Jetzt ist es Yu und ihren Kollegen jedoch gelungen, mehr Licht in das Tentakelgewirr der Kernpore zu bringen. Dafür setzten sie eine neue Kombination aus synthetischer Biologie, multidimensionaler Fluoreszenzmikroskopie und computerbasierten Simulationen ein. „Wir haben die spaghettiartigen Proteine mit Fluoreszenz-Farbstoffen markiert, die wir mit Licht anregen und im Mikroskop sichtbar machen können“, erklärt Yus Kollege Edward Lemke. „Anhand der Leuchtmuster und Leuchtdauer konnten wir ableiten, wie die Proteine angeordnet sein müssen.“
Im nächsten Schritt ermittelten die Forschenden mithilfe weiterer Mikroanalysen und computergestützten Modellierungen, wie sich die Kernporen-Proteine in der lebenden Zelle verhalten. „Mit Moleküldynamik-Simulationen haben wir berechnet, wie die ungeordneten Proteine in der Porenöffnung räumlich organisiert sind, wie sie miteinander wechselwirken und sich bewegen. Zum ersten Mal konnten wir so das Tor zur Steuerzentrale der menschlichen Zellen visualisieren“, berichtet Koautor Gerhard Hummer vom Max-Planck-Institut für Biophysik in Frankfurt am Main.
Schutzschild aus zappelnden Molekülen
Es zeigte sich: Die rund 300 Fangarme in der Kernpore verhalten sich anders als gedacht – und das von ihnen gebildete Netz lässt sich im Reagenzglas nicht nachvollziehen. Nur in der lebenden Zelle und der Umgebung der Kernpore können die komplexen Wechselwirkungen dieser Protein-Tentakel ablaufen, wie die Forschenden feststellten. Das erklärt auch, warum für die Bildgebung präparierten Zellproben bisher immer nur ein Loch an Stelle der Farngarme zeigten.
Die Analysen enthüllten auch, dass sich die Kernporen-Proteine ständig bewegen und so einen Schutzschild aus zappelnden, spaghettiartigen Molekülen bilden. Viren oder Bakterien sind zu groß, um durch dieses Sieb zu gelangen. Zelleigene, im Kern benötigte große Moleküle können dagegen passieren, wenn sie eine „Eintrittskarte“ in Form bestimmter chemischer Sequenzen aufweisen, wie die Ergebnisse von Yu und ihrem Team bestätigten.
„Neue Ära der Erforschung von Kerntransportprozessen“
„Indem wir die Struktur des Poreninneren entschlüsselt haben, eröffnen wir eine neue Ära der Erforschung von Kerntransportprozessen“, sagt Koautor Martin Beck vom MPI für Biophysik. Denn wenn man verstehe, wie die Kernporen Fracht transportieren oder blocken, könne man auch Fehlfunktionen dieser Barriere leichter identifizieren. „Immerhin schaffen es einige Viren trotz der Barriere, in den Zellkern zu gelangen“, sagt Hummer.
„Mit unserer Methodenkombination können wir nun die intrinsisch ungeordneten Proteine genauer untersuchen und herausfinden, warum sie für bestimmte Zellfunktionen unverzichtbar sind, obwohl sie fehleranfällig sind“, so der Forscher weiter. Denn solche ungeordneten Proteine kommen nicht nur in der Kernpore vor, sondern auch in anderen zellulären Zusammenhängen – beispielsweise im Gehirn. „Sie bergen das Risiko, während des Alterungsprozesses Aggregate zu bilden, die zu neurodegenerativen Krankheiten wie Alzheimer führen können“, erklärt Lemke. (Nature, 2023; doi: 10.1038/s41586-023-05990-0)
Quelle: Universität Mainz