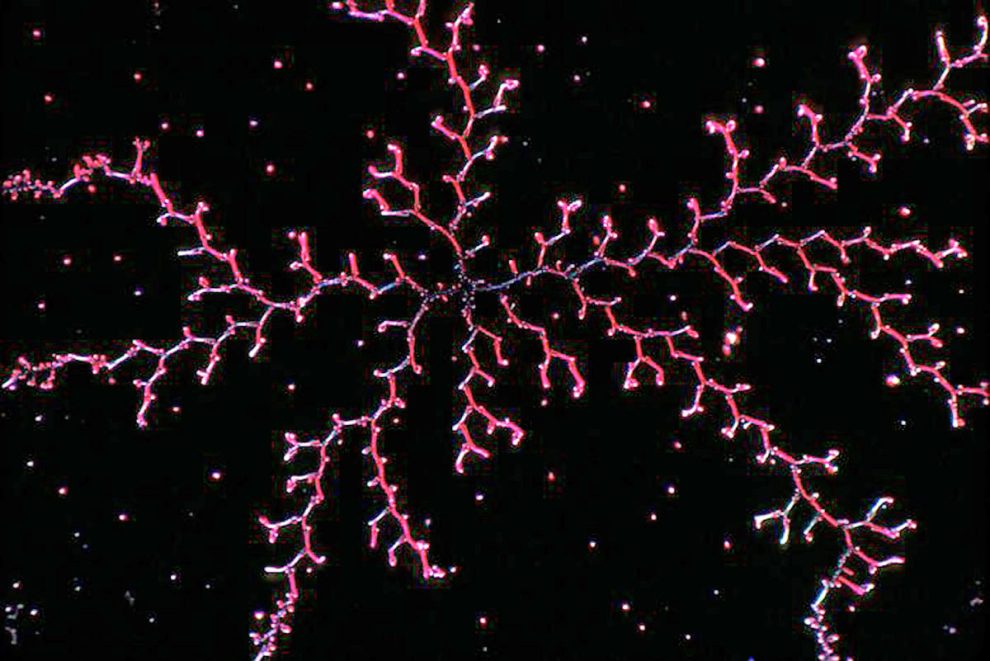
Diese feinen roten Verästelungen sind zwar winzig klein, dafür aber wahre Lebensretter. Es handelt sich bei ihnen um Cisplatin-Kristalle, eines der wichtigsten Medikamente bei der Chemotherapie gegen Krebs. Die platinhaltige Verbindung stoppt die übermäßige Zellteilung von Krebszellen und bekämpft so die Erkrankung. Allerdings kommt es immer wieder zu tödlich verlaufenden Resistenzen gegen das Medikament. Forschende haben nun womöglich einen Weg gefunden, diese zu verhindern.
Pro Jahr erkranken in Deutschland rund eine halbe Million Menschen an Krebs. Durch Mutationen und DNA-Schäden ausgelöst teilen sich einzelne Körperzellen bei ihnen unkontrolliert und wachsen zu bösartigen Tumoren heran. Um den so entstandenen Krebs zu behandeln, müssen die Krebszellen beseitigt und ihre unkontrollierte Teilung verhindert werden. Das geschieht meist im Rahmen einer Chemotherapie.
Schwermetall mit Heilwirkung
Eines der wichtigsten und am häufigsten genutzten Chemo-Medikamente ist das Cisplatin. Es kommt hauptsächlich bei der Behandlung von Hoden-, Blasen- und Eierstockkrebs zum Einsatz, aber auch bei Gebärmutterhalskrebs und Bronchialkarzinomen. Wie der Name bereits vermuten lässt, handelt es sich bei Cisplatin um eine platinhaltige Schwermetallverbindung, die in fein verästelter Kristallform vorliegt.
Unter normalen Umständen wären giftige Schwermetalle etwas, was wir nicht unbedingt in unserem Körper haben möchten. Doch im Rahmen der Krebstherapie machen sich Ärzte die zellschädigende Wirkung des Cisplatins zunutze. Einmal intravenös verabreicht, wandert das Medikament ins Zellinnere und sorgt dort für Chaos an den DNA-Strängen, indem es diese wahllos miteinander vernetzt. Die in den Strängen enthaltene Erbinformation kann so nicht mehr richtig abgelesen werden, die DNA-Verdopplung und Zellteilung stoppen, die Zelle stirbt ab.
Da das Cisplatin nicht zwischen gesunden und Krebszellen unterscheiden kann, trifft es beide gleichermaßen, wodurch Patienten häufig eine Vielzahl an Nebenwirkungen erleben, darunter Übelkeit, Störungen des Nervensystems und Unfruchtbarkeit. Weil sich Krebszellen jedoch besonders oft teilen, wirken sich die von Cisplatin verursachten DNA-Veränderungen bei ihnen stärker aus und führen zum Absterben der Tumorzellen.
Der Cisplatin-Resistenz auf der Spur
Doch die Nebenwirkungen sind nicht das einzige Problem des Cisplatins. Zwar bekämpft es den Krebs zunächst äußerst effizient, doch einige Patienten entwickeln irgendwann eine Resistenz gegen das Schwermetall, wodurch sowohl ihr Therapieerfolg als auch ihr Leben in Gefahr sind. Allein bei Eierstockkrebs-Patientinnen entwickelt mehr als die Hälfte eine solche Resistenz, wodurch jährlich 200.000 von ihnen sterben.
Forschende um Attila Szénási von der Xi’an Jiaotong-Liverpool University haben nun aber womöglich einen Weg gefunden, die Entwicklung solcher Resistenzen zu verhindern. Dafür mussten sie zunächst herausfinden, was genau die Resistenzbildung verursacht. Als Übeltäter entlarvten die Forschenden das eigentlich zellschützende Enzym Superoxid-Dismutase 1, kurz SOD1. In Gegenwart des Cisplatins erhöht es seine Aktivität, um die Zelle vor der Wirkung des Schwermetalls zu schützen, schadet damit aber dem Erfolg der Chemotherapie.
Verfahren bei Mäusen geglückt
Um die SOD1-Aktivität künstlich herunterzuregeln, haben Szénási und seine Kollegen sogenannte small interfering RNA (siRNA) in den Körper von Mäusen mit Eierstockkrebs eingeschleust. Dabei handelt es sich um kurze RNA-Stücke, die sich mit der Boten-RNA abgelesener Genen verbinden und diese so blockieren. Die im Experiment eingesetzte siRNA kann dadurch die Produktion von SOD1 stoppen. Und tatsächlich: Bei den Mäusen, die mit siRNA behandelt wurden, nahm die Cisplatin-Resistenz ab und die Tumore gingen zurück.
Bis das Verfahren allerdings bei Menschen angewandt werden kann, ist es noch ein langer Weg. Szénási und sein Team müssen zunächst einen geeigneten Weg finden, die siRNA bis zu den entsprechenden Genen schleusen, ohne dabei anderweitige Schäden zu verursachen oder die Wirkung der Chemotherapie zu mindern. (Cancer Gene Therapy, 2023; doi: 10.1038/s41417-023-00659-2)
Quelle: Xi’an Jiaotong-Liverpool University