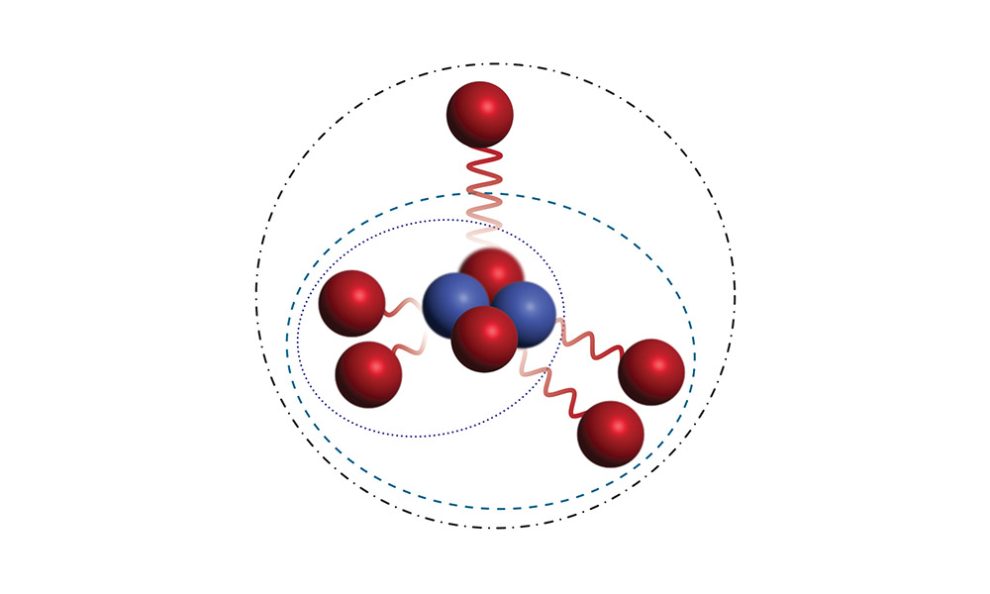
Exotisches Atom: Physiker haben ein neues, leichtes Isotop des Stickstoffs entdeckt, das neben seinen sieben Protonen nur zwei Neutronen enthält – ein extremes Missverhältnis der Kernbausteine. Dieses Isotop Stickstoff-9 ist damit die leichteste bekannte Variante des Stickstoffs. Gleichzeitig ist es der erste Atomkern, der durch Abgabe von gleich fünf Protonen zerfällt, wie die Forscher berichten. Verursacht wird dies durch die ungewöhnliche Struktur dieses Atomkerns, die einer russischen Matrioschka-Puppe ähnelt.
Die meisten Elemente im Periodensystem kommen in Form verschiedener Isotope vor: Ihre Atomkerne haben zwar jeweils die gleiche Zahl an Protonen, die Zahl ihrer Neutronen variiert jedoch. Gängigen Modellen nach sind dabei vor allem die Isotope stabil, die ungefähr gleich viele Protonen und Neutronen haben. Je unausgewogener das Verhältnis der Nukleonen ist, desto eher neigt ein Isotop zum Zerfall – es ist radioaktiv.
Stickstoff-Isotope und ungebundene Protonen
Auch beim Stickstoff ist dies so: Bei 99,634 Prozent dieses Elements enthalten die Atome jeweils sieben Protonen und sieben Neutronen und bilden das stabile Isotop 14N. Das ebenfalls stabile Isotop 15N enthält ein Neutron mehr und macht die restlichen 0,366 Prozent des Elements aus. Doch im Labor lassen sich zusätzlich zu diesen natürlich vorkommenden Stickstoffvarianten auch noch künstliche, meist sehr kurzlebige Isotope mit mehr oder aber weniger Neutronen herstellen.
Das Spannende daran: Je extremer das Ungleichgewicht zwischen Protonen und Neutronen wird, desto exotischer ist auch die Struktur dieser Isotope. Ihre Atomkerne können länglich verformt sein oder sogar ihre kompakte Struktur verlieren: Einige der Kernbausteine sind dann nur noch lose mit dem Rest des Atomkerns verbunden. Kernphysiker sprechen im Extremfall von ungebundenen Kernbausteinen. Die Grenze, ab der diese Gebilde überhaupt noch als ein Atomkern definierbar sind, ist fließend.