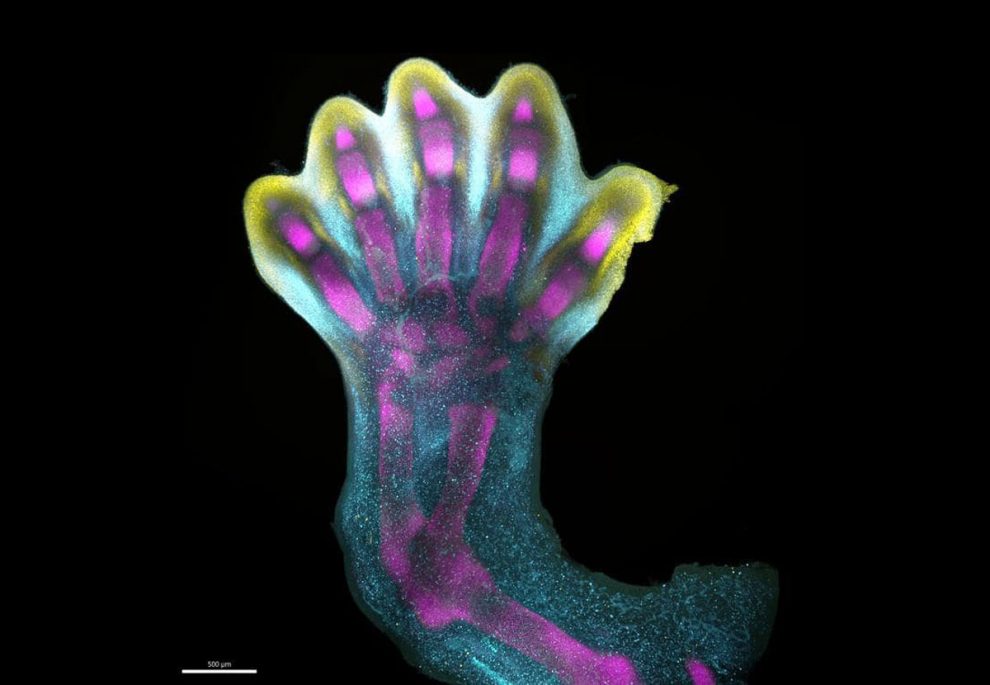
Frühe Füße: In den ersten sieben bis acht Wochen unseres Lebens sehen unsere Füße noch so aus wie auf diesem Bild – eher wie eine kleine Hand. Zu diesem Zeitpunkt formen sich unsere Zehen gerade aus einem kugeligen Zellknubbel, der gezielt jene Zellen zurückbildet, die noch in den späteren Zehenzwischenräumen liegen. Forschende haben diese Gliedmaßenentwicklung nun erstmals im Detail beobachten und kartieren können und berichten in „Nature“ von ihren Erkenntnissen.
Unser Leben beginnt als befruchtete Eizelle, die sich immer weiter teilt. Nach und nach bilden sich dabei verschiedene Gewebetypen heraus. Aus ihnen entstehen dann zum Beispiel unser Gehirn, unser Herz oder unsere Hände. Erst nach und nach entwickelt der Embryo im Mutterleib sein typisch menschliches Aussehen, darunter Hände mit langen Fingern und opponierbaren Daumen.
Vom Knubbel zum Fuß
Wie die Entwicklung vom Zellhaufen zum kleinen Menschen aussieht, ist allerdings noch nicht in allen Details bekannt. Denn aus ethischen und technischen Gründen konnten wir die Embryonalentwicklung bislang nur bei Modellorganismen wie Mäusen in ganzer Länge verfolgen. Menschliche Embryos oder Embryos aus menschlichen Stammzellen dürfen dagegen nur bis zu einem Alter von 14 Tagen im Labor gezüchtet werden.
Aus den bisherigen Studien wissen wir aber immerhin grob, wie sich zum Beispiel unsere Hände und Füße bilden. Beide bestehen zu Beginn aus einem kugelförmigen Zellknubbel. Erst indem sich einige dieser Zellen im Laufe der Zeit wieder gezielt zurückbilden, nimmt der Knubbel irgendwann die Form eines menschlichen Fußes mit fünf Zehen beziehungsweise einer Hand mit fünf Fingern an.
Blick in den frühen Fuß
Forschende um Bao Zhang von der Sun-Yat-sen-Universität haben nun erstmals im Detail beobachten können, wie genau der Prozess der Gliedmaßenbildung abläuft und welche zellulären sowie genetischen Mechanismen dabei eine Rolle spielen. Dafür untersuchten sie das Gewebe von abgetriebenen Embryos, die zwischen fünf und neun Wochen alt waren.
In insgesamt rund 125.000 Zellen der embryonalen Beine und Füße markierten Zhang und seine Kollegen die Aktivität verschiedener Gene. Indem sie diese Genkarten aus unterschiedlichen Entwicklungsabschnitten miteinander kombinierten, konnten die Forschenden schließlich „live“ dabei zusehen, wie einem menschlichen Embryo Füße wachsen.
Fußbildung durch Zelltod
„Was wir enthüllen, ist ein hochkomplexer und präzise regulierter Prozess“, berichtet Zhang. „Es ist, als würde man einem Bildhauer bei der Arbeit zusehen, der einen Marmorblock zu einem Meisterwerk meißelt. In diesem Fall ist die Natur der Bildhauer, und das Ergebnis ist die unglaubliche Komplexität unserer Finger und Zehen“. Eine der Genkarten, die Zhang und sein Team erstellt haben, ist auf dem obigen Bild zu sehen.
Die Aufnahme zeigt einen Embryonenfuß zwischen der siebten und achten Schwangerschaftswoche. Magenta kennzeichnet dabei die Aktivität des für die Skelettentwicklung wichtigen Gens SOX9. In Blau ist die Aktivität des Gens IRX1 dargestellt, das für die Bildung der Finger und Zehen entscheidend ist. Gelb steht wiederum für das Gen MSX1. Es sorgt für den programmierten Zelltod der „überflüssigen“ Zellen, die in den späteren Zehenzwischenräumen liegen. Erst das Zusammenspiel dieser und vieler weiterer Gene ermöglicht schließlich die Bildung typisch menschlicher Füße.
Ursachen für Fehlbildungen gefunden
Doch angesichts der komplizierten Prozesse, die bei der Gliedmaßenbildung ablaufen, kann dabei auch einiges schiefgehen. Im Schnitt hat einer von 500 Menschen eine Fehlbildung an Händen oder Füßen, zum Beispiel in Form einer Brachydaktylie, bei der die Finger ungewöhnlich kurz ausfallen, oder einer Polysyndaktylie, bei der Betroffene mehr als fünf Finger beziehungsweise Zehen pro Gliedmaße aufweisen.
Zhang und seine Kollegen konnten mit ihrer Kartierung nun herausfinden, welche Muster der embryonalen Genaktivität zu den verschiedenen Fehlbildungen führen. Mit diesen Kenntnisse lassen sich nun womöglich Diagnose und Behandlung der unterschiedlichen Gliedmaßensyndrome verbessern. (Nature, 2023; doi: 10.1038/s41586-023-00000-0)
Quelle: Wellcome Trust Sanger Instiute