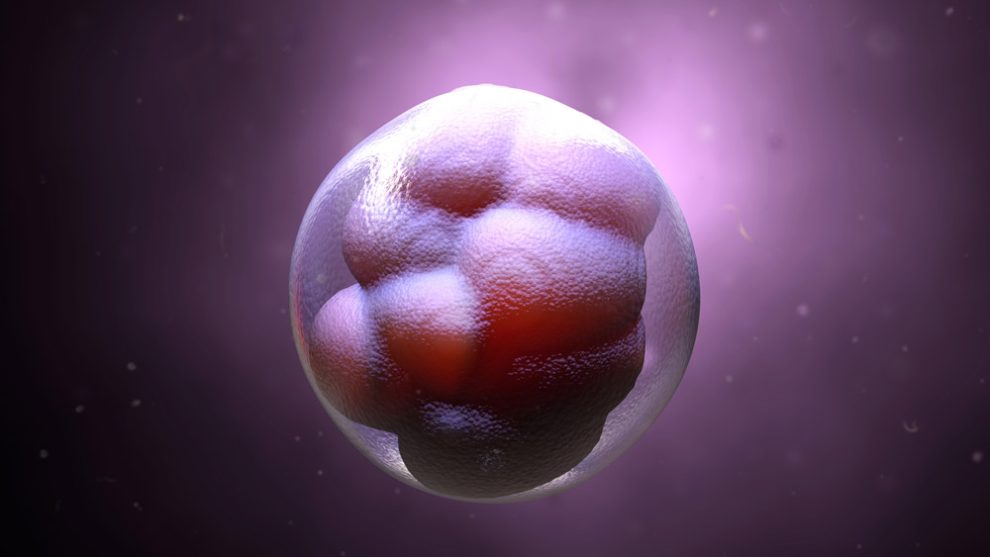
Virale Helfer: Unser Erbgut enthält Überreste uralter Retroviren, die sich vor hunderten Millionen Jahren in die DNA unserer tierischen Vorfahren integriert haben. Eine Studie zeigt nun, dass diese Virengene eine wichtige Rolle bei der frühen Embryonalentwicklung spielen: Sie regulieren den Übergang der ersten embryonalen Zellen zur Pluripotenz und ermöglichen so ihre weitere Entwicklung – auch bei uns Menschen. Fehlt dieser virale Umschalthelfer, scheitert die Schwangerschaft schon kurz nach der Befruchtung
Rund zehn Prozent unseres Erbguts stammen ursprünglich von Viren. Diese endogenen Retroviren (ERVs) entstanden, als urzeitliche Erreger ihre DNA ins Erbgut ihrer Wirte integrierten – angefangen bei den ersten Tieren vor mehr als 500 Millionen Jahren. Dieses genetische Erbe früherer Infektionen hat sich bis heute erhalten – auch im Genom des Menschen. Viele dieser viralen Überreste werden zwar nicht mehr abgelesen, einige sind aber bis heute aktiv.
Welche Auswirkungen die Viren-DNA in unserem Genom hat, ist bislang nur in Ansätzen verstanden. So gibt es Hinweise darauf, dass sie das Risiko für Krankheiten wie Demenz und Multiple Sklerose erhöhen können. Andererseits scheinen manche Virenreste vor Krebs zu schützen und das Muskelwachstum bei Männern zu fördern.
Von der Totipotenz zur Pluripotenz
Ein Team um Sergio de la Rosa vom Spanischen Nationalen Krebsforschungszentrum (CNIO) in Madrid ist nun auf eine weitere hilfreiche Funktion der endogenen Retroviren gestoßen: Sie regulieren einen entscheidenden Schritt in der Embryonalentwicklung. Nach der Befruchtung teilt sich die Eizelle zunächst in zwei Zellen, die beide totipotent sind. Sie können sich noch zu allen Zelltypen des Körpers differenzieren und einen eigenständigen Organismus entwickeln.