Jahrzehnte altes Rätsel gelöst: Im Arbeitsalltag unserer Zellen liegt die DNA als wirres, eng verdrehtes Knäuel vor, doch wie vermeidet sie dabei blockierende Knoten? Das haben Wissenschaftler nun geklärt. Mithilfe der Cryo-Elektronenmikrospie beobachteten sie den entscheidenden Schritt und entdeckten Überraschendes: Die DNA selbst „fängt“ die Knotenlöser-Enzyme wie mit einem Lasso ein und sorgt so dafür, dass diese an der richtigen Stelle aktiv werden, wie das Team in „Science“ berichtet.
Würde man das Erbgut aus einer unserer Zellen lang ausbreiten, dann wäre dieser DNA-Strang fast zwei Meter lang. Damit die DNA in den winzigen Zellkern passt, muss sie entsprechend komprimiert werden. Bei den Zellteilungen geschieht dies durch einen komplexen Verpackungsprozess, bei dem die kompakten, geordnet gefalteten Chromosomen entstehen. Doch während der normalen Zellaktivität müssen die Gene und andere DNA-Abschnitte zugänglich und ablesbar sein. Daher liegt die DNA dann in einem losen, wirren Knäuel vor.
Das Problem jedoch: In einem solchen DNA-Knäuel können sehr schnell Knoten entstehen, die das Ablesen der DNA erschweren oder sogar ganz blockieren – die zuständigen Enzyme bleiben an den engen Strangüberkreuzungen buchstäblich stecken. Gleichzeitig erzeugt aber gerade das Ablesen neue Verwicklungen: Wenn ein Teil der in sich verdrillten DNA gestreckt und entdreht wird, erzeugt dies zusätzliche Spannung und Windungen in den angrenzenden Abschnitten – ein sogenanntes Supercoiling.
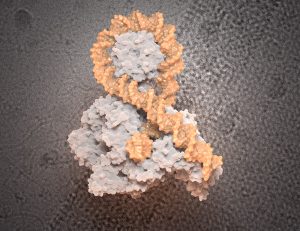
Wie funktioniert die DNA-Entknotung?
Wie die DNA es schafft, blockierende Knoten bei diesem Supercoiling zu verhindern, war bislang unklar. Zwar ist bereits bekannt, dass unser Erbgut dafür spezielle Enzyme, die sogenannten Topoisomerasen nutzt. Diese spalten einen oder beide DNA-Stränge vorübergehend und ermöglichen so ein Durchfädeln und Entwirren potenziell zu enger Windungen. „Wie die Topoisomerasen aber die DNA-Kreuzungen erkennen, die eine problematische Verknotung darstellen, ist eine offene Frage“, erklären Marlène Vayssières von der Universität Strasburg und ihre Kollegen.
Um den Entknotungs-Trick der DNA zu klären, haben Vayssières und ihr Team erstmals entsprechend verknäuelte DNA-Abschnitte im Labor hergestellt und die Entwirrungs-Enzyme in Aktion beobachtet. Als Testobjekt nutzten sie die Gyrase, die beim Bakterium Escherichia coli aktive Topoisomerase-Variante. Mittels Cryo-Elektronenmikroskopie fingen sie verschiedene Stadien der Erbgut-Entknotung ein und konnten so mitverfolgen, was dabei genau geschieht.
Mit Lassotrick und Helix-Schere
Die Aufnahmen enthüllten Überraschendes: Der entscheidende Akteur für die Entknotung ist zwar das Enzym, dieses wird aber aktiv von der DNA eingefangen und gewissermaßen zur Hilfe gezwungen. „Stellen Sie sich ein Rodeo vor: Die verdrehte DNA fängt die Gyrase wie mit einem Lasso“, erklärt Koautorin Lynn Zechiedrich vom Baylor College of Medicine in Houston. Das Enzym positioniert sich dadurch im Inneren der engen DNA-Schlaufe.
Dann folgt der zweite Schritt: „Die jetzt von der eng gewundenen DNA-Schlaufe umgebene Gyrase schneidet nun eine DNA-Helix in der Schlaufe, schiebt die zweite DNA-Helix durch die Lücke und schließt den Schnitt wieder“, beschreibt Zechiedrich das Beobachtete. Dieser Vorgang entspannt die Überdrehung und lockert die engen Windungen. Im Experiment war dies an einer Verlängerung des verknäuelten DNA-Strangs um rund 75 Nanometer erkennbar. „Dies entspricht der Auflösung von rund 1,25 Supercoils“, berichtet das Team.
45 Jahre alte Theorie bestätigt
Damit geben die neuen Beobachtungen erstmals genaueren Einblick darin, wie unser Erbgut sein Supercoiling reguliert und zu enge Knoten verhindert. „Sie zeigen, dass die DNA kein passives Biomolekül ist, an dem die Enzyme rumarbeiten“, sagt Koautor Jonathan Fogg vom Baylor College. „Stattdessen ist sie aktiv und nutzten Supercoiling, Looping und 3D-Formen, um Enzyme wie die Gyrase je nach Situation zu spezifischen DNA-Abschnitten zu leiten.“
Gleichzeitig bestätigen die neuen Ergebnisse eine schon vor 45 Jahren aufgestellte Theorie. Nach diesem DNA-Strang-Inversionsmodell erzeugt das Topoisomerase-Enzym negative, entspannte DNA-Abschnitte, indem sie sich an einen positiven Supercoil anlagert und schneidet. Dies führt zu einer Entspannung des DNA-Strangs und einem negativen Supercoiling, das nun das Ablesen des betroffenen DNA-Abschnitts ermöglicht. (Science, 2024; doi: 10.1126/science.adl5899)
Quelle: Baylor College of Medicine