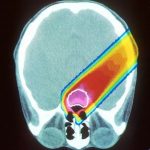
Das Wissen darüber, dass die Fresszellen des Immunsystems von den Krebszellen manipuliert werden und zu ihnen „überlaufen“, lässt sich auch in der Krebstherapie nutzen. Der Tumorbiologe Florian Greten von der Geothe-Universität Frankfurt hat die Anfänge dieser Forschung während seiner Zeit als Postdoktorand zu Beginn der 2000er Jahre an der University of California in San Diego miterlebt.

Entzündungswege blockieren, Krebswachstum hemmen
Damals war bekannt, dass Menschen, die regelmäßig Aspirin nehmen, ein geringeres Darmkrebsrisiko haben. Man führte dies auf die entzündungshemmende Wirkung des Medikaments zurück, wusste aber nicht, warum dies funktioniert. Greten untersuchte deshalb einen für Entzündungen zentralen Signalweg, der über ein Protein läuft, das die Herstellung anderer Proteine steuert, den Transkriptionsfaktor NF-Kappa-B. Er reguliert die Ausschüttung proinflammatorischer Botenstoffe (Zytokine). Unterbricht man den Signalweg, kann keine Entzündung entstehen.
2004 konnte Greten an Mäusen mit Darmkrebs tatsächlich zeigen, dass die Ausschaltung von NF-Kappa-B das Krebswachstum hemmt – und zwar egal, ob der Signalweg in den Tumorzellen selbst oder in den umgebenden Makrophagen unterbrochen wurde. „Das war das erste Mal, dass wir zeigen konnten: Es hat einen Einfluss auf das Tumorwachstum, wenn wir einen Zelltyp aus seiner Umgebung, der ja nicht mutiert ist, behandeln“, erinnert sich Greten.
„Die Forschung ist dann quasi explodiert. Leute haben angefangen, immer mehr Signalwege in Makrophagen anzuschauen. Es gab mehr und mehr genetische Modelle, die untersucht haben, was Makrophagen machen, wenn sie in die eine oder in die andere Richtung differenziert werden.“