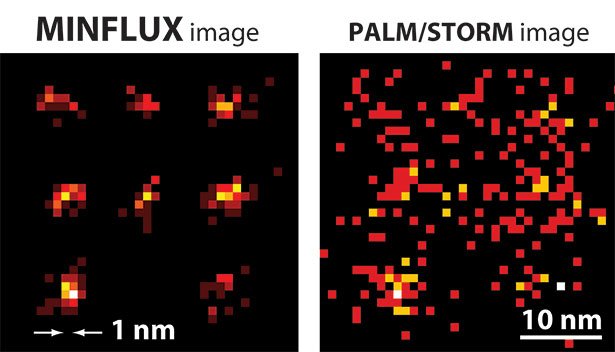
Forscher haben scheinbar Unmögliches möglich gemacht: Sie haben ein Fluoreszenzmikroskop entwickelt, das eine Auflösung von einem Nanometer erreicht – eine Schärfe, die in der Lichtmikroskopie bisher als nicht machbar galt. Das MINFLUX getaufte Mikroskop kann
sogar einzelne Moleküle optisch voneinander trennen und ist gut 100 Mal schärfer und schneller als alle bisherigen Lichtmikroskope.
Eigentlich schienen die Grenzen klar: Schon 1873 erkannte der Physiker Ernst Abbe, dass die Auflösung von Lichtmikroskopen auf die halbe Wellenlänge des Lichts begrenzt ist – das sind etwa 200 Nanometer. Dann jedoch entdeckte Stefan Hell vom Max-Planck-Institut für biophysikalische Chemie einen Weg, Abbes Auslösungsgrenze zu umgehen. Er entwickelte das STED-Mikroskop und bekam dafür 2014 den Nobelpreis. Das STED erreicht eine Trennschärfe von etwa 20 bis 30 Nanometern – rund zehn Mal besser als das Abbe-Limit. Zwei US-Forscher erreichten fast die gleiche Auflösung mit einer anderen Methode, dem PALM/STORM-Mikroskop und bekamen dafür ebenfalls einen Teil des Nobelpreises.
Bis auf den Nanometer genau
Jetzt haben Hell und seine Kollegen noch eins draufgesetzt: Es gelang ihnen, die Vorteile beider Methoden zu kombinieren und ein völlig neues, noch auflösungsstärkeres Fluoreszenz-Mikroskop zu entwickeln. Mit dem MINFLUX genannten Mikroskop lassen sich erstmals Moleküle optisch voneinander trennen, die nur Nanometer voneinander entfernt sind. Damit ist es mehr als 100 Mal schärfer als herkömmliche Lichtmikroskope
„Ich bin überzeugt, dass MINFLUX-Mikroskope das Zeug dazu haben, eines der grundlegendsten Werkzeuge der Zellbiologie zu werden“, sagt Hell. „Mit diesem Verfahren wird es in Zukunft möglich sein, Zellen molekular zu kartografieren und schnelle Vorgänge in ihrem Inneren in Echtzeit sichtbar zu machen. Das könnte unser Wissen über die molekularen Abläufe in lebenden Zellen revolutionieren.“
Zeitversetzt mit Doughnut-Strahl
Wie aber funktioniert das neue „Super-Mikroskop“? Sowohl STED als auch PALM/STORM trennen benachbarte fluoreszierende Moleküle, indem sie diese nacheinander an- und ausschalten. Die STED-Mikroskopie setzt dafür einen Doughnut -förmigen Laserstrahl ein, der das Leuchten der Moleküle an festgelegten Koordinaten in der Probe unterdrückt. Dadurch ist die Position des gerade leuchtenden Ausschnitts genau bekannt, aber der Doughnut ist zu groß für einzelne Moleküle.
PALM/STORM hingegen regt nacheinander Moleküle mit jeweils verschiedenfarbigen Fluoreszenzmarker an und überlagert die Einzelaufnahmen. Erst die Kombination unterläuft die Auflösungsgrenze. Der Vorteil: Im Prinzip sieht man einzelne Moleküle, kennt aber ihre genauen Positionen nicht.
MINIFLUX kombiniert nun die Stärken beider Techniken in einem neuen Konzept. Wie PALM/STORM schaltet es einzelne Moleküle zufällig an und aus. Gleichzeitig bestimmt es aber – wie STED – deren exakte Position mit einem Doughnut-förmigen Laserstrahl. „Es war ein unglaubliches Gefühl, als wir zum ersten Mal mit MINFLUX Moleküle auf der Skala von wenigen Nanometern unterscheiden konnten“, sagt Hells Kollege Klaus Gwosch.
Hundertfach schneller
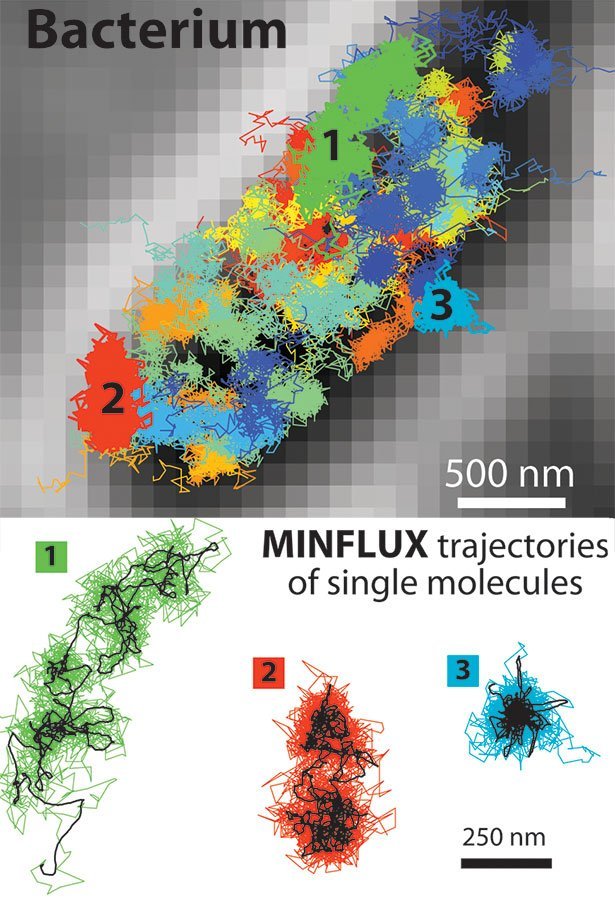
Neben der molekularen Auflösung bietet die Kombination von STED und PALM/STORM einen weiteren großen Vorteil: „MINFLUX ist im Vergleich sehr viel schneller: Da die Technik mit dem Doughnut-Laserstrahl arbeitet, kommt sie mit wesentlich weniger Lichtsignal, das heißt Fluoreszenz-Photonen, pro Molekül aus als PALM/STORM“, erklärt Hell. Dadurch kann man beispielsweise Molekülen in einer lebenden Zelle bei ihren Bewegungen zusehen.
Bereits mit STED konnte man solche Echtzeit-Videos aus dem Inneren lebender Zellen aufnehmen. Doch mit MINIFLUX hat sich die zeitliche Auflösung noch einmal um das 100-Fache erhöht. Den Forschern gelang es beispielsweise die Bewegung von Molekülen in einem lebenden Escherichia coli-Bakterium in bisher unerreichter Zeitauflösung zu „filmen“.
Nach Ansicht der Wissenschaftler ist ihr neues Fluoreszenz-Mikroskop ein echter Durchbruch und eröffnet der Wissenschaft grundlegend neue Möglichkeiten zu erforschen, wie Leben auf molekularer Ebene abläuft. Mit MINIFLUX könnten sich künftig selbst extrem schnelle Abläufe in lebenden Zellen untersuchen lassen – etwa die Bewegung zellulärer Nanomaschinen oder die Faltung von Proteinen. (Science, 2016; doi: 10.1126/science.aak9913)
(Science/ Max-Planck-Gesellschaft, 23.12.2016 – NPO)