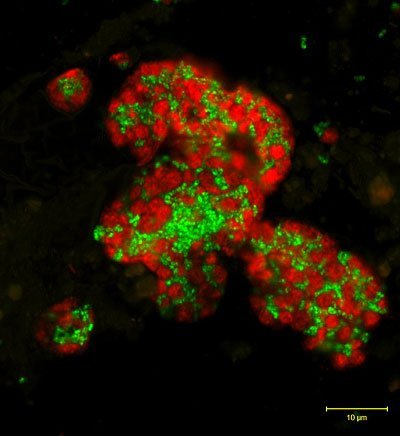
Stoffwechsel verkehrt herum: Manche Mikroorganismen im Meeresboden verbrauchen offenbar die „falsche“ Sorte Methan. Wissenschaftler gingen bislang davon aus, dass biochemische Prozesse vor allem leichte Kohlenstoffisotope verbrauchen. Unter bestimmten Voraussetzungen kehrt sich dies jedoch um, wie deutsche und amerikanische Forscher jetzt im Fachmagazin „Nature Geoscience“ berichten. Der entschlüsselte Vorgang könnte auch für andere Umsatzprozesse im Meer von Bedeutung sein.
Im Meeresboden sind Nährstoffe oft knapp, Mikroorganismen müssen mit dem auskommen, was vorhanden ist: Methan zum Beispiel. Davon sind im Ozeangrund geschätzte 500 bis 10.000 Milliarden Tonnen gespeichert. Einige Mikroorganismen sind in der Lage, dieses Methan mit Hilfe von Sulfat als Kohlenstoff- und Energiequelle zu nutzen. Methan dient einerseits als Energieträger und ist andererseits ein starkes Treibhausgas. Weniger als zwei Prozent des in die Atmosphäre freigesetzten Methans stammen aber aus dem Meeresboden, trotz der gewaltigen dort vorhandenen Mengen. Dies liegt an der Aktivität der Mikroorganismen, die das austretende Treibhausgas verbrauchen.
Rätselhafte Isotopenverteilung
Wissenschaftler um Marcos Yoshinaga vom Zentrum für Marine Umweltwissenschaften an der Universität Bremen (MARUM) untersuchten diese Prozesse näher und analysierten Isotopengehalte von Methan aus weltweiten Meeresablagerungen. Verschiedene Isotope eines Elements, wie etwa Kohlenstoff, enthalten gleich viele Protonen, unterscheiden sich jedoch in ihrer Neutronenzahl und damit ihrer Masse. Zwar zeigen sie keine Unterschiede im Verhalten bei chemischen Reaktionen, wohl aber hinsichtlich ihrer Reaktionsgeschwindigkeiten: die schwereren Isotope reagieren langsamer.
Dadurch wird bei biogeochemischen Prozessen in der Regel das leichte Kohlenstoff-Isotop 12C bevorzugt, während das schwere Isotop 13C übrig bleibt. Im Meeresboden stießen die Forscher jedoch immer wieder auf ein seltsames Phänomen: Dort, wo Mikroorganismen mit Hilfe von Sulfat im Meeresboden Methan verbrauchen, blieb im restlichen Methan nicht wie erwartet das schwere Kohlenstoff-Isotop 13C zurück, sondern der leichtere Kohlenstoff 12C. Die von den MARUM-Forschern vorgefundene Situation schien damit dem Grundsatz zu widersprechen, dass Mikroorganismen bei der Oxidation von Methan vorrangig das leichtere 12C umsetzen
Labortests bestätigen Funde
Um ihre Funde zu überprüfen, stellte das Forscherteam die im Meeresboden ablaufenden Prozesse im Labor am Max-Planck-Institut für Marine Mikrobiologie in Bremen nach. Und tatsächlich: Wenn den Mikroorganismen nur sehr wenig Sulfat zur Verfügung stand, blieb in den Laborkulturen, wie auch im Meeresboden beobachtet, Methan zurück, dass mit dem leichten 12C angereichert war.
Anschließend wollten die Bremer Forscher auch die Frage beantworten, warum sich bei niedrigen Sulfatgehalten 12C im Methan anreichert. Sie erklären die umgedrehte Anreicherung folgendermaßen: Biogeochemische Reaktionen sind Gleichgewichte, die in beiden Richtungen ablaufen können. Normalerweise, bei ausreichendem Nährstoffangebot, werden diese Gleichgewichtsreaktionen jedoch vom Überschuss auf der einen Seite in eine bestimmte Richtung getrieben. Organismen machen sich dies für ihre Stoffwechselprozesse zunutze.
Methanverbrauch am Limit für die Existenz von Leben
Bei einem Mangel an Sulfat, wie er in den rätselhaften Proben herrscht, läuft die Umsetzung von Methan jedoch nahe am energetischen Limit für die Existenz von Leben. Unter solchen Bedingungen befinden sich alle beteiligten Stoffe bei der Reaktion nahezu im Gleichgewicht, die Reaktion kann also nahezu genauso gut in eine Richtung wie auch die andere ablaufen. „Aufgrund dessen landet das leichte 12C wieder im Methan“, erklärt Gunter Wegener vom Max-Planck-Institut. „Diesen Befund konnten wir mit Hilfe unserer biogeochemischen Modelle untermauern und damit ein global vorhandenes Phänomen erklären“, bestätigt Tobias Goldhammer vom MARUM.
„Unsere Studie ermöglicht neue Einblicke, wie bestimmte Archaeen, die unter großem Energiemangel tief im Meeresboden leben, ihre Stoffwechselvorgänge an diese Bedingungen anpassen. Damit liefert sie Antworten auf eine der zentralen Fragen unseres Projekts“ fügt Projektleiter Kai-Uwe Hinrichs hinzu. In einem nächsten Schritt wollen die Wissenschaftler klären, ob solche Reaktionen auch andere wichtige biogeochemische Prozesse im Meeresboden wie etwa die Methanbildung selbst beeinflussen.
(Nature Geoscience, 2014; doi: 10.1038/ngeo2069)
(MARUM – Zentrum für Marine Umweltwissenschaften an der Universität Bremen, 28.01.2014 – AKR)