Zum ersten Mal haben Forscher mit einem Röntgenlaser ein kleines Biomolekül fast bis auf das Atom genau abgebildet. Der energiereiche Röntgenblitz ließ noch Strukturen von rund 0,19 Nanometer Größe deutlich erkennen – das ist nur wenig mehr als der Durchmesser eines Wasserstoff-Atoms. „Das erlaubt uns, bisher unkartiertes Gelände der Biologie zu erkunden“, sagt Henry Chapman vom Deutschen Elektronen Synchrotron (DESY) in Hamburg, einer der Autoren der im Fachmagazin „Science“ veröffentlichten Studie. Denn mit solchen Röntgenlasern könnten nun auch Biomoleküle untersucht werden, deren Struktur herkömmliche Methoden nicht abbilen können – beispielsweise Eiweiße aus der Membran von Zellen.
Die Struktur von Biomolekülen ist von großer Bedeutung für Medizin und Biologie, denn ihre Funktion hängt oft von ihrer genauen Form ab. So verbinden sich viele dieser biologisch aktiven Substanzen nur mit ganz bestimmten Andockstellen an Zellen oder Organen. So wie ein Schlüssel im Schloss eine Tür öffnet, entfalten auch die Biomoleküle erst bei passender Bindungsstelle ihre Wirkung. Um neue Medikamente zu entwickeln, ist es meist entscheidend, die genaue Form solcher Andockstellen und ihrer Schlüssel zu kennen.
Beugungsmuster verrät Molekülstuktur
Die Struktur vieler Biomoleküle lässt sich jedoch mit herkömmlichen Methoden nur schwer bestimmen. Denn dafür müssen die Substanzen in oft aufwändigen Verfahren in größere Kristalle umgewandelt werden. Werden diese Kristalle dem Röntgenlicht ausgesetzt, streut ihr regelmäßiges Atomgitter die Strahlung und bildet dabei ein bestimmtes Beugungsmuster. Dieses verrät die Struktur des Moleküls. Viele Biomoleküle lassen sich jedoch nicht in ausreichend große Kristalle umwandeln. Meist werden sie zudem von der energiereichen Röntgenstrahlung zerstört, bevor ein Bild entsteht.
Das Experiment des internationalen Forscherteams zeigt nun, dass die sogenannten Freie-Elektronen-Laser (FEL) Abhilfe schaffen können. Denn die Röntgenblitze dieser Instrumente sind so hell, dass bereits winzigste Kristalle und sehr wenig Zeit ausreichen, um gute Beugungsbilder aufzunehmen, wie die Forscher berichten. Zwar werden auch dabei die Moleküle fast sofort zerstört, aber die Röntgenstrahlen bilden die Struktur der Proben ab, bevor sie verdampft. „Der Schlüssel sind die ultrakurzen Pulse – es zeigt sich kein Schaden, bevor der Röntgenpuls nicht schon vorbei ist“, sagt DESY-Forscher Anton Barty.
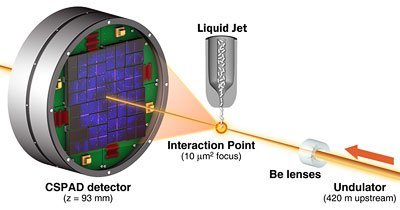
Kristalle fließen durch den Röntgenlaserstrahl
Für ihre Studie erzeugten die Forscher zunächst winzige, nur maximal drei Mikrometer kleine Kristalle des Biomoleküls Lysozym aus dem Hühnereiweiß. Diese Kristalle leiteten sie, vermischt mit einer Flüssigkeit, durch den pulsierenden Strahl des Röntgenlasers am SLAC National Accelerator Laboratory im kalifornischen Menlo Park. Jeder Röntgenpuls des Lasers war dabei nur fünf Femtosekunden lang – dies entspricht fünf Billardstel Sekunden.
Trafen die Röntgenpulse auf ein Lysozym-Molekül, entstand ein Beugungsmuster, das von einem Detektor aufgezeichnet wurde. Aus diesem konnten die Forscher die Struktur des Moleküls rekonstruieren. Mit Hilfe der intensiven Pulse sei dies so fein möglich, dass man schon auf die Position einzelner Atome schließen könne, sagt Erstautor Sébastien Boutet vom SLAC National Accelerator Laboratory. Die Demonstration zeige, dass die Technik funktioniert und ebne den Weg für eine Vielzahl spannender künftiger Experimente. (Science, 2012; doi:10.1126/science.1217737)
(Science/DESY, 01.06.2012 – NPO)












