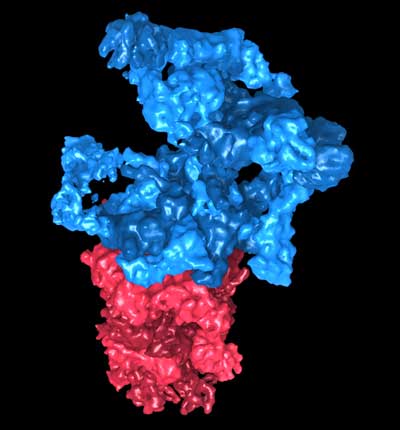
Werden fehlerhafte Proteine nicht vom Körper abgebaut, können sie Krankheiten verursachen. Wissenschaftlern ist es jetzt gelungen, die Struktur der „Müllabfuhr“ der Zelle (26S-Proteasom) aufzuklären. Die Ergebnisse der neuen Studie sind ein wichtiger Schritt für die weitere Erforschung des 26S-Proteasoms, schreiben die Forscher in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS).
In einer Zelle dürfen zu einem bestimmten Zeitpunkt ihrer Entwicklung nur die Proteine vorhanden sein, die sie gerade benötigt. Andernfalls können unerwünschte Reaktionen auftreten, die beispielsweise zu Krebs führen können. Außerdem müssen die Proteine die korrekte Form aufweisen, um ihre Aufgaben erfüllen zu können.
Sind sie falsch gefaltet, können sie verklumpen und neurodegenerative Krankheiten wie Alzheimer oder Parkinson die Folge sein. Um das zu verhindern, verfügt der Körper über verschiedene Mechanismen, die den Proteinhaushalt regulieren und wenn nötig Proteine abbauen.
Zelluläre Müllabfuhr
Eine zentrale Rolle beim Proteinabbau spielt die zellulären Proteinabbau-Maschinerie, das 26S-Proteasom. Fehlgefaltete und potentiell gefährliche Proteine werden zunächst mit dem zellulären Etikett Ubiquitin verknüpft. Das 26S-Proteasom erkennt die markierten Proteine und zerlegt sie in ihre Bestandteile, die dann wiederverwertet werden.
Seine Struktur konnten Wissenschaftler um Wolfgang Baumeister vom Max-Planck-Institut (MPI) für Biochemie jetzt zusammen mit Kollegen der University of California San Francisco und der Eidgenössischen Technischen Hochschule Zürich entschlüsseln.
Viele Puzzleteile führen zur Struktur
„Die Struktur des 26S-Proteasoms ändert sich laufend“, erklärt MPI- Forscher Friedrich Förster. „Daher konnte sie mit Hilfe traditioneller Ansätze wie etwa der Röntgenkristallographie allein bisher nicht aufgeklärt werden. Erst die Kombination verschiedener Methoden brachte den Erfolg.“
Die Elektronenmikroskopie und die Massenspektrometrie halfen dabei, den groben Aufbau des 26S-Proteasoms zu enthüllen. Die Röntgenkristallographie gewährte detaillierte Einblicke in einzelne Bereiche des Moleküls. Am Computer setzten die Forscher die unterschiedlichen Daten dann zu einem Gesamtbild zusammen.
Mechanismen des Proteinabbaus enthüllen
Basierend auf diesen Ergebnissen wollen die Forscher künftig untersuchen, wie die verschiedenen Mechanismen des Proteinabbaus funktionieren. „Wir haben bereits eine Hypothese entwickelt, wie genau das 26S-Proteasom markierte Proteine erkennt und weiterverarbeitet“, so MPI-Wissenschaftler Stefan Bohn.
Die vollständige Aufklärung des 26S-Proteasoms und der zugrunde liegenden Mechanismen könnte den Forschern zufolge auch von medizinischer Bedeutung sein: Die „zelluläre Müllabfuhr“ sei ein denkbarer therapeutischer Ansatzpunkt bei Krebs und neurodegenerativen Krankheiten. (Proceedings of the National Academy of Sciences (PNAS), 2012.
(MPG, 24.01.2012 – DLO)