Blaualgen, auch Cyanobakterien genannt, legen unter normalen Bedingungen ein Energiepolster an, das es ihnen erlaubt, unter Stress wie langer Dunkelheit zu überleben. Verantwortlich dafür ist ein molekularer Schalter in einem Enzym. Entfernt man diesen Schalter, sollte man die überschüssige Energie der Bakterien für biotechnologische Zwecke wie die Wasserstoffproduktion nutzen können, ohne dass es ihnen dadurch schlechter geht, berichtet ein internationales Wissenschaftlerteam im „Journal of Biological Chemistry“.
Als Speicher für die mittels Photosynthese gewonnene Energie in Pflanzen dient das energiereiche Molekül ATP. Auf- und bei Bedarf auch wieder abgebaut wird es vom Enzym ATPase. Um das Bakterium gegen Stresssituationen mit zu viel oder zu wenig Licht zu wappnen, verfügt die ATPase der Blaualgen über einen kleinen Bereich, der wie ein Schalter wirkt. Er verhindert, dass das ATP bei Dunkelheit, wenn keine Photosynthese läuft, vorschnell wieder abgebaut wird. Das Bakterium legt so einen Vorrat an Energie an, der ihm über Stressphasen hinweg hilft.
Allerdings verlangsamt dieser Schalter auch die Geschwindigkeit des photosynthetischen Elektronentransports mit der Wasserspaltung im Licht: „Man muss sich das so vorstellen, als würde man gegen einen Widerstand etwas in einen vollen Speicher pressen wollen“, verdeutlicht Professor Matthias Rögner von der Ruhr-Universität Bochum.
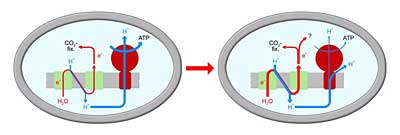
Schalter-Bereich der ATPase entfernt
Er und seine Kollegen haben zusammen mit Forschern vom Tokyo Institute of Technology im Experiment den Schalter-Bereich der ATPase bei Cyanobakterien gentechnisch entfernt. „Wir haben natürlich erwartet, dass es den Bakterien danach viel schlechter gehen würde und dass sie viel langsamer wachsen würden“, erklärt er. „Aber das traf nicht zu.“
Die Bakterien wuchsen unter Laborbedingungen – also ohne Lichtstress – ganz wie gewöhnlich, so die Forscher. Allerdings legen sie einen geringeren ATP-Energiespeicher an, weswegen sie sehr lange Dunkelphasen schlechter überleben als der Wildtyp. Andererseits steht nun prinzipiell die überschüssige Energie im Licht, die sonst in den Speicher wandert, zur biotechnologischen Nutzung zur Verfügung.
Auf dem Weg zum biotechnologischen Wasserstoff
„Dies sollte es ermöglichen, zukünftig mindestens 50 Prozent der aus der lichtgetriebenen Wasserspaltung gewonnenen Energie für andere Prozesse zu verwenden, zum Beispiel für eine solargetriebene biologische Wasserstoffproduktion durch cyanobakterielle Massenkulturen in Photobioreaktoren“, schätzt Rögner. (Journal of Biological Chemistry, 2011; DOI: 10.1074/jbc.M111.234138)
(Ruhr-Universität Bochum, 29.07.2011 – DLO)