Zu viel Licht ist schädlich: Dies gilt auch für Photosynthese betreibende Organismen. Blaualgen beispielsweise haben deshalb verschiedene Strategien, mit denen sie sich gegen „Lichtüberschuss“ wappnen. Die molekularen Grundlagen eines dieser Schutzmechanismen haben Bochumer Biologen jetzt mit modernsten massenspektrometrischen Verfahren untersucht – mit überraschenden Ergebnissen.
{1r}
Denn sie konnten beobachten, dass die auch Cyanobakterien genannten Lebewesen bei zu viel Licht eine „Stress“-Kopie eines wichtigen Proteins herstellt, das an der Photosynthese beteiligt ist. Es erlaubt ihnen, mehr Licht in harmlose Wärmestrahlung umzuwandeln. Lässt der Lichtstress nach, wird wieder das normale Protein hergestellt. Die Forscher berichten im „Journal of Biological Chemistry“ über ihre Ergebnisse.
Extrem anpassungsfähig
Cyanobakterien sind so anpassungsfähig, dass sie von der Arktis über die Wüste bis hin zu heißen Quellen vorkommen. Marine Cyanobakterien sind ein wichtiger Klimafaktor, da sie erheblich zur globalen CO2-Fixierung beitragen. Als photosynthetische Bakterien können sie Licht in Energie umwandeln. Grundlage dafür ist die photosynthetische Elektronentransportkette.
Aktive Komponenten sind große Membranproteinkomplexe, die das Licht einfangen und für den Transport von Elektronen nutzen. Einer dieser Komplexe – das Photosystem 2 – katalysiert eine in der Natur einzigartige Reaktion: die Photolyse von Wasser. Als Nebenprodukt der Photolyse wird Sauerstoff freigesetzt, der die Grundlage für alles tierische Leben auf der Erde darstellt.
„Somit waren es die Cyanobakterien, die vor circa 3,5 Milliarden Jahren für eine sauerstoffhaltige Atmosphäre sorgten und damit letztendlich auch den Lebensraum des Menschen schufen“, unterstreicht Marc Nowaczyk von der Ruhr-Universität Bochum (RUB).
Warum zu viel Licht schädlich ist
Auch wenn Cyanobakterien – wie alle photosynthetischen Organismen – Licht als Energiequelle für ihren Stoffwechsel nutzen, ist zu viel Licht schädlich. Insbesondere schwankende Lichtintensitäten führen zu einem Ungleichgewicht innerhalb der Elektronentransportkette und gegenüber nachgeschalteten Reaktionen.
Das kann bewirken, dass Elektronen nicht schnell genug abgeführt werden können, was Rückreaktionen begünstigt. Besonders das Photosystem 2 ist als erster Komplex in der Kette von diesem Prozess betroffen: Es werden vermehrt Sauerstoffradikale gebildet, die extrem schädlich für die Zelle sind.
Trick der Cyanobakterien zur Vorbeugung
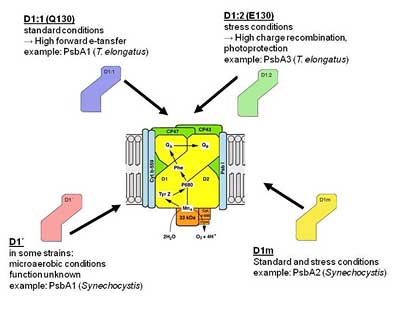
Das Photosystem 2 besitzt einen äußert effizienten und einzigartigen Reparaturmechanismus, der Gegenstand aktueller Forschung ist. „Hauptschädigungsort im Komplex ist das zentrale D1-Protein, das selektiv abgebaut und kontinuierlich durch eine neue Kopie ersetzt wird“, erklärt Nowaczyk. „Dieser Reparaturzyklus sorgt dafür, dass der photosynthetische Elektronentransport trotz Lichtstress aufrecht erhalten werden kann.“
Cyanobakterien haben darüber hinaus eine Strategie entwickelt, die schon vor einer Schädigung des Proteins ansetzt: Sie besitzen eine Genfamilie, die verschiedene D1-Proteine kodiert. Bereits in früheren Studien konnte durch Genexpressionsanalysen gezeigt werden, dass eine dieser Kopien nur unter Lichtstress gebildet wird.
Einblicke in molekulare Grundlagen des Schutzmechanismus gewonnen
„Durch modernste massenspektrometrische Verfahren konnten wir diesen Effekt nun erstmals auch direkt auf Proteinebene nachvollziehen und durch Studien an D1-Mutanten Einblicke in die molekularen Grundlagen des Schutzmechanismus gewinnen“, so Nowaczyk. Die alternative „Stress“-Kopie des D1-Proteins bewirkt, dass der Komplex insgesamt einen größeren Anteil des empfangenen Lichts in harmlose Wärmestrahlung umwandeln kann. Somit wird auf Kosten der Effizienz einer Schädigung vorgebeugt.
Ändern sich die Lichtbedingungen erneut, wird wieder die „normale“ D1-Kopie gebildet und der Komplex nutzt das eingestrahlte Licht wieder äußerst effizient für die Photosynthese. „Gerade diese molekulare Variabilität ist die Grundlage für die erfolgreiche Besiedelung verschiedenster Lebensräume mit unterschiedlichsten Lebensbedingungen“, folgern die Forscher.
(idw – Ruhr-Universität Bochum, 19.10.2010 – DLO)