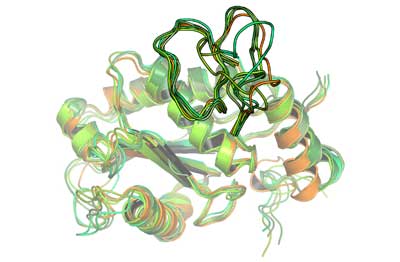
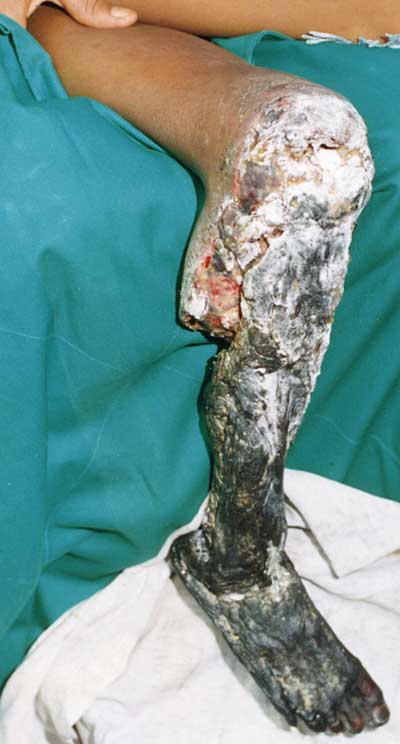
Vipernbisse können unbehandelt zum Absterben von Gliedmaßen des Opfers und sogar zu dessen Tod führen. Innsbrucker Chemiker haben jetzt erstmals nachgewiesen, dass diese gefürchtete Wirkung des Schlangengiftes von der Beweglichkeit eines Enzyms im Giftcocktail abhängt. Sie stellen die Ergebnisse ihrer neuen Studie im „Journal of the American Chemical Society“ ausführlich vor.
Einige Viperngifte führen aufgrund ihrer Blutgefäß-zersetzenden Wirkung zum Absterben des umgebenden Gewebes, wobei sich diese Wirkung oft auf das gesamte vom Biss betroffene Körperteil ausbreitet. Obwohl die Aminosäuresequenz und sogar die Struktur der Giftproteine in Viperngiften bekannt sind, gab es bis heute jedoch keine Erklärung, warum manche dieser Enzyme zu ausgedehnten Gewebeschäden führen, während andere nur einen örtlich beschränkten Schaden bewirken. Für Schlangengiftexperten war dies umso erstaunlicher, da die Sequenz und Struktur der aktiven und inaktiven Giftproteine nahezu identisch sind.
Unterschiede in der Beweglichkeit entscheidend
Das Forscherteam um Professor Klaus R. Liedl vom Institut für Allgemeine, Anorganische und Theoretische Chemie der Universität Innsbruck konnte nun erstmals eine Erklärung für dieses Phänomen finden und nachweisen.
„Hannes Wallnöfer aus unserer Arbeitsgruppe konnte mittels Computersimulation erstmals zeigen, dass der Unterschied zwischen den einzelnen Giftproteinen nicht durch ein statisches Bild der Enzyme erklärt werden kann“, erläutert Liedl. Demnach ist die unterschiedliche Wirkung nicht auf Unterschiede in der Struktur sondern auf Unterschiede in der Beweglichkeit zurückzuführen.
Forscher entwickeln Hemmstoffe
„Es konnte nachgewiesen werden, dass die Beweglichkeit der Giftproteine dafür verantwortlich ist, dass die zerstörerische Wirkung der Giftproteine weiträumig im Körper auftritt und es so zu den ausgedehnten Gewebeschäden kommt. Ist dieser bestimmte Bereich der Giftproteine nicht beweglich, so kommt es nicht zu der gefürchteten zersetzenden Wirkung“, verdeutlicht der Chemiker Liedl.
Die neuen Erkenntnisse sollen nun dazu dienen, Hemmstoffe zu entwickeln, um die Giftproteine an ihrer zerstörerischen Wirkung zu hindern. Dadurch könnte Opfern von Schlangenbissen in Zukunft viel effektiver geholfen werden.
Internationale Kooperation
Dieses für die Behandlung von Schlangenbissen bahnbrechende Ergebnis war nur aufgrund einer sehr engen internationalen Zusammenarbeit von Arbeitsgruppen in Costa Rica, Freiburg und Innsbruck möglich.
„In Costa Rica wurden die Vipern ‚gemolken‘ und die Aktivität des Giftes bestimmt. In Freiburg wurden die Proteine gereinigt, kristallisiert und deren Struktur bestimmt, bevor wir in Innsbruck aufbauend auf diesen Ergebnissen Computersimulationen durchgeführt haben, um die Beweglichkeit der Proteine zu bestimmen“, beschreibt Liedl den Forschungsprozess.
(Universität Innsbruck, 07.09.2010 – DLO)