Nach 20 Jahren des Versuchens ist es Forschern jetzt gelungen, die Struktur eines wichtigen Enzyms des Aids-Virus zu entschlüsseln. Das Enzym Integrase spielt eine Schlüsselrolle beim Einschleusen des Virengenoms in das Erbgut der Wirtszelle und liefert damit viel versprechende Ansatzstellen für bessere Wirkstoffe. Der jetzt in „Nature“ beschriebene Durchbruch gelang, weil das Enzym erstmals in die Kristallform überführt werden konnte.
{1l}
Schon seit einiger Zeit existieren neue Wirkstoffe gegen Aids, die das Enzym Integrase blockieren und damit die Vermehrung des Virus verhindern. Wie allerdings diese Blockade funktioniert, war unklar, denn die Struktur des Enzyms war unbekannt. Die Aidsforscher wussten nur, dass die Integrase dafür verantwortlich ist, die genetische Information des Virus in die zelleigene DNA einzufügen. Ohne diesen Schritt ist eine Vermehrung des Virus in der Wirtszelle nicht möglich.
Kristallisation scheiterte bisher
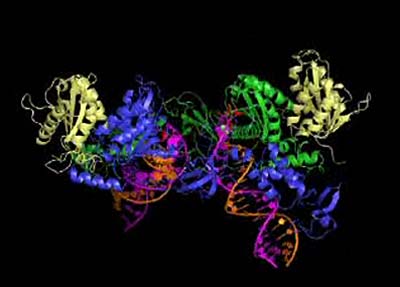
Versuche, die Struktur der Integrase zu entschlüsseln scheiterten daran, dass es nicht gelang, das Protein in seine Kristallform zu überführen – nur mit dieser kann eine Röntgen-Kristallographie durchgeführt werden. Bei dieser erzeugt die Ablenkung und Streuung der Röntgenstrahlen durch die Bestandteile des Kristalls ein charakteristisches Muster, aus dem sich die Abstände und Bindungen der Atome rekonstruieren lassen.
Jetzt ist es Wissenschaftlern vom Imperial College London und der Harvard Universität erstmals gelungen, einen Integrase-Kristall zu erzeugen, mit dem die Röntgen-Kristallographie durchgeführt werden konnte. „Das ist eine wirklich erstaunliche Geschichte”, erklärt Peter Cherepanov, Hauptautor der Studie vom Imperial College. „Als wir anfingen, wussten wir, dass das Projekt schwierig war und das schon viele Tricks von anderen versucht und aufgegeben worden waren. Deshalb gingen wir ganz zurück an den Anfang und begannen neu, indem wir nach einem besser für die Kristallisation geeigneten Modell der Integrase suchten.“
Enzym von verwandtem Virus genutzt
Weil die HIV-Variante des Enzyms sich als so widerspenstig erwiesen hatte, wichen die Forscher auf die Integrase eines verwandten Retrovirus aus, dem so genannten Prototype Foamy Virus (PFV). Da die Funktion des Enzyms in beiden Viren gleich ist, sollte auch die Struktur gleich oder zumindest extrem ähnlich sein, so die Ausgangshypothese der Wissenschaftler. Im Laufe von vier Jahren und mehr als 40.000 Versuchen gelang es ihnen schließlich, sieben verschiedene Integrase-Kristalle zu erzeugen. Davon erwies sich nur ein einziger als für die Röntgen-Kristallographie geeignet.
Erfolg nach 40.000 Versuchen
„Trotz der anfangs quälend langsamen Fortschritte und der vielen Fehlversuche, haben wir nicht aufgegeben und unsere Mühen zahlten sich schließlich aus“, so Cherepanov. Mit Hilfe der Synchrotronenstrahl-Anlage in South Oxfordshire führten sie mit diesem Kristall die Röntgen-Kristallographie durch und gewannen so Aufschluss über seine Struktur. Überraschenderweise entpuppte sich diese als deutlich verschieden von den bisherigen Annahmen und Schätzungen.
Weg frei für neue Wirkstoffe
Um herauszufinden, wie das Enzym arbeitet, gingen die Forscher noch einen Schritt weiter: Sie tauchten die Integrase-Kristalle in Lösungen der antiretroviralen Wirkstoffe Raltegravir und Elvitegravir, die beide bei der Behandlung HIV-Infizierter eingesetzt werden. Anschließend führten sie erneut eine kristallographische Analyse durch. Anhand der Konformationsänderungen konnten sie erstmals beobachten, wie diese Aids-Medikamente an das Enzym binden und es deaktivieren.
Die Entschlüsselung der Struktur und des Wirkmechanismus des Enzyms ebnen nun den Weg zu einer Verbesserung der bestehenden Wirkstoffe und auch zur Entwicklung neuer, effektiverer und schonender Blockadestoffe für diese Ansatzstelle.
(Imperial College London, 02.02.2010 – DLO)