Grippeviren sind extrem wandlungsfähig und dadurch schwer zu bekämpfen. Jetzt ist es Wissenschaftlern gelungen, neue Angriffspunkte aufzuspüren, die weniger anfällig für Resistenzentwicklung sein könnten. Das Neue daran: Die Ansatzstellen sind Proteine im menschlichen Körper, nicht im Erreger, wie die Forscher in „Nature“ berichten.
{1l}
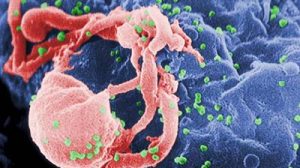
Infektionen mit Influenzaviren können lebensbedrohlich sein und führen alleine in Deutschland zu mehreren Tausend tödlichen Krankheitsverläufen pro Jahr. Neuartige Influenzaviren wie beispielsweise der „Schweinegrippe“ bergen zusätzliche Risiken. Es gibt zwar wirksame Grippemedikamente, doch diese versagen immer häufiger, weil Influenzaviren dagegen resistent geworden sind. Wissenschaftlern am Max-Planck-Institut für Infektionsbiologie in Berlin ist es nun gelungen, neue Angriffspunkte aufzuspüren, die weniger anfällig für Resistenzentwicklung sein könnten.
Menschliche Proteine für Vermehrung nötig
Grippeviren hängen bei ihrer Vermehrung stark von den Proteinen der infizierten Zelle ab; die meisten davon waren allerdings bisher nicht im Zusammenhang mit Influenza bekannt. Die Wissenschaftler haben nun mit Hilfe der sogenannten „RNA Interferenz“ in einem automatisierten Verfahren jedes Gen des Menschen einzeln nacheinander gehemmt und damit die Bildung einzelner Proteine verhindert. Anschließend infizierten die Forscher die Zellen mit Influenzaviren und testeten die verbliebene Vermehrungsfähigkeit der Viren.
287 Wirtszellfaktoren identifziert
Dieses systematische Vorgehen ermöglichte es den Max-Planck-Forschern Alexander Karlas, Nikolaus Machuy sowie Thomas F. Meyer gemeinsam mit weiteren Kollegen unter den rund 24.000 Genen des Menschen insgesamt 287 Wirtszellfaktoren aufzuspüren, die bei der Virusvermehrung beteiligt sind. Viele der identifizierten Proteine sind für unterschiedliche Influenzaviren gleichermaßen bedeutsam, darunter auch das neue pandemische H1N1 Virus. In Zusammenarbeit mit Thorsten Wolff vom Robert Koch-Institut wurden auch hoch-gefährliche H5N1 Viren, die Erreger der „Vogelgrippe“ untersucht, die ebenfalls von den identifizierten humanen Genen abhängig waren.
Mögliche Anwendungen für die Therapie
Die jetzt neu gefundenen Wirtszellfaktoren, die für das Zustandekommen und den Verlauf von Influenzainfektionen unerlässlich sind, werden nun am Max-Planck-Institut weiter untersucht. Langfristiges Ziel ist die Entwicklung von Medikamenten, die diese Wirtszellfaktoren blockieren, ohne nennenswerte Nebenwirkungen hervorzurufen. Die Forscher gehen davon aus, dass solche neuartigen Virustatika kaum zu einer Resistenzentwicklung der Viren führen und sich auch gegen bisher unbekannte Influenzasubtypen als wirksam erweisen.
Vorstellbar wäre auch, die identifizierten humanen Gene mittels der Methode der RNA Interferenz selbst zu hemmen. Die im Jahr 2006 mit einem Nobelpreis ausgezeichnete Techologie bietet sich nicht nur zur Charakterisierung infektionsrelevanter Genfunktionen des Menschen an, sondern darüber hinaus auch als therapeutische Anwendung. Mit der Untersuchung derartiger Anwendungen der RNA-Interferenz wurde bereits im Jahre 2004 mit dem von Professor Meyer koordinierten europäischen Forschungsverbund (RIGHT) begonnen.
Ausschalten von Genen als Therapieansatz?
Mit der sich immer stärker verdichtenden Erkenntnis, dass für den Verlauf von Infektionen beide Seiten, nämlich die des Erregers und die seines Wirts, benötigt werden, eröffnen sich neue Chancen für die Behandlung akuter und chronischer Infektionen. „In der Zukunft wird die Strategie, menschliche Genfunktionen zu bestimmten Zeiten gezielt abzuschalten, eine wichtige Rolle auch bei der Bekämpfung von Infektionskrankheiten einnehmen – neben dem Einsatz von Antibiotika und Impfstoffen,“ sagt Professor Thomas Meyer, Geschäftsführender Direktor des Berliner MPI und Leiter der Forschergruppe.
„Zwar erscheint uns das Ausschalten menschlicher Genfunktionen auf den ersten Blick als problematisch, aber es handelt sich um genau dasselbe therapeutische Prinzip, das wir seit Jahrzehnten zur medikamentösen Behandlung sonstiger Erkrankungen von Krebs bis hin zu lästigen Kopfschmerzen erfolgreich heranziehen. Also warum nicht auch für die Therapie von Infektionskrankheiten?“
(Max-Planck-Gesellschaft, 19.01.2010 – NPO)