Marburger Forscher haben zwei Wege untersucht, die es ermöglichen, ein membranständiges Protein an mindestens einer Stelle gezielt chemisch zu verändern. Durch die Ankoppelung einer so genannten Kronenether-Verbindung verändern die künstlich erzeugten Ionenkanäle ihre Leitfähigkeit, berichten die Wissenschaftler in der Fachzeitschrift „Angewandte Chemie“.
Ionenkanäle sind für den Stoffwechsel wichtige Poren in biologischen Membranen, durch die Ionen von einer Seite der Membran auf die andere gelangen.
Membranproteine verlieren schnell ihre Form
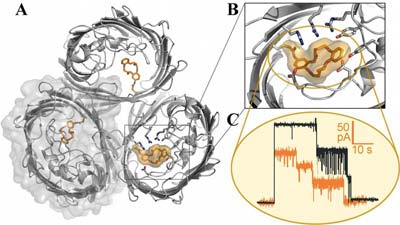
„Membranproteine sind sehr schwierig in der Handhabung, weil sie schnell ihre Form verlieren – deshalb sind auch Kristallisation und Strukturanalyse sehr problematisch“, erläutert Professor Dr. Lars-Oliver Essen von der Universität Marburg, der zusammen mit seinem Kollegen Professor Dr. Ulrich Koert für die neue Studie verantwortlich war. Als Modellsystem verwendeten die Wissenschaftler das Poren formende Protein „OmpF“, das „Outer membrane protein F“.
Essen und Koert wählten zwei Herangehensweisen, um synthetisch abgeänderte Ionenkanäle zu erzeugen: Bei der einen Route wurde der Großteil des Membranproteins bereits im Bakterium auf biosynthetischem Weg hergestellt, ein kleinerer Teil dagegen durch chemische Festphasensynthese. Beide Fragmente wurden sodann über eine spezielle Koppelungsreaktion miteinander verknüpft.
Problem: Rückfaltung des Membranproteins
Für diese halb biologische, halb chemische Syntheseweise ist die außerordentliche Stabilität vom OmpF entscheidend, da sich das Protein nach der Verknüpfungsreaktion wieder in seine dreidimensionale Struktur zurückfalten muss. „Diese Rückfaltung eines Membranproteins ist alles andere als trivial, oder um einen Vergleich aus der japanischen Faltkunst Origami zu benutzen, nicht jedes Papier lässt sich gut falten“, so Essen.
Bei der anderen Syntheseroute für veränderte Ionenkanäle wurde OmpF komplett im Bakterium Escherichia coli hergestellt. Diesmal führten die Forscher die Anknüpfungsstelle für die chemische Modifikation durch eine Mutation ein.
Perfekte Zusammenarbeit
Dem von der Volkswagen-Stiftung unterstützten Projekt kamen sehr unterschiedliche Expertisen aus Biochemie, organischer Synthese und Elektrophysiologie zugute. Essen betont, dass sich die beiden Forscherteams hervorragend ergänzt hätten – die AG Essen beschäftigt sich mit biologischen Strukturen, die AG Koert mit den Synthesen chemischer Verbindungen.
(idw – Universität Marburg, 06.04.2009 – DLO)