Was aus einer Stammzelle wird, das bestimmen Signale von außen, unter anderem elektrische Felder und Spannungsunterschiede. Bochumer Biochemiker haben auf diesem bisher wenig erforschten Signalweg nun einen zellulären Spannungssensor entlarvt: Der Kaliumkanal KCNQ1 vermittelt die bioelektrischen Informationen an die Zelle.
Manipulationen daran bringen die Entwicklung durcheinander, so die Forscher um Dr. Guisgard Seebohm von der Ruhr-Universität Bochum (RUB) in der aktuellen online-Ausgabe der Fachzeitschrift „Proceedings of the National Academy of Science“ (PNAS).
Stammzellen spezialisieren sich – aber auf welches Signal hin?
Stammzellen der Neuralleiste differenzieren sich in Wirbeltieren zu einer Reihe verschiedener Zellen wie Gefäßmuskelzellen, periphere Nervenzellen, Knorpelzellen, Knochenzellen, hormonproduzierenden Zellen und Pigmentzellen, die Schlüsselrollen in der Entwicklung des Gesichtes, des Herzens und anderer Gewebe übernehmen.
Die Entwicklung von Stammzellen zu den verschiedenen spezialisierten Zelltypen des entstehenden Embryos wird durch komplexe Wechselwirkungen von Zellen untereinander gesteuert. Stammzellen haben genau definierte, in engen Grenzen gehaltene elektrophysiologische Eigenschaften, die die Grundlage für spezifische zelluläre Verständigung sein könnten. Bisher war die Bedeutung elektrischer Signale für Stammzellen unklar. Zudem war unbekannt, wie die elektrophysiologischen Signale auf die Zellen wirken.
Froscheier bringen Licht ins Dunkel
Licht in diese Frage brachten die Arbeiten der Bochumer Forscher, die sie an Embryonen des afrikanischen Krallenfrosches durchführten. Da die elektrischen Eigenschaften einer Zelle durch Ionenkanäle und Transporter in der Zellmembran bestimmt werden, durch die elektrisch geladene Teilchen hinein- und herausgelangen, brachten sie Erbmaterial von Ionenkanälen und Transportern in die Froscheier ein und beobachteten deren weitere Embryonalentwicklung.
Neben diesen genetischen Manipulationen beeinflussten sie die Ionenkanäle und Transporter auch pharmakologisch, indem sie die Froschembryonen so genannten Ionenkanalmodulatoren aussetzten.
Manipulationen am Kaliumkanal und seine Auswirkungen
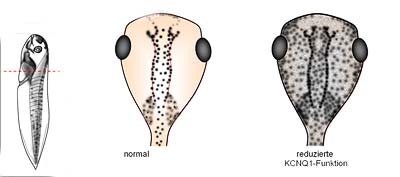
Dabei entdeckten sie, dass der spannungsabhängige Kaliumkanal KCNQ1 – auch Kv7.1 und KvLQT1 genannt – die Eigenschaften einer spezifischen Stammzellpopulation der Neuralleiste kontrolliert. Dieser Kaliumkanal gehört zu einer „alten“ Kanalfamilie, das heißt, es gibt ihn seit einer frühen Phase der Evolution und daher in vermutlich allen Wirbeltieren. Fehlfunktionen sind bei Menschen an komplexen Krankheiten wie dem ererbten plötzlichen Herztod, Schwerhörigkeit und Epilepsie beteiligt.
„Werden die Funktionen dieser Kanäle in den sich entwickelnden Embryonen durch genetische Manipulationen oder pharmakologische Wirkstoffe verändert, so teilen sich die Pigmentzellen der Neuralleiste vermehrt und wandern in Gewebe ein, in denen sie normalerweise nicht zu finden sind“, beschreibt Seebohm seine Erkenntnisse.
Anhebung des Ruhemembranpotentials in den Froschzellen
Die Forscher konnten auch den Mechanismus klären, der dahinter steckt: Eine Hemmung des KCNQ1-Kaliumkanals führt zu einer Anhebung des Ruhemembranpotentials in den Froschzellen. Dies wiederum bewirkt, dass bestimmte Gene (Sox10, Slug und Miff) vermehrt abgelesen und die entsprechenden Proteine in größerer Menge produziert werden. Sie wiederum bewirken, dass sich die Zellen öfter teilen und in untypische Regionen einwandern.
„Wir vermuten, dass der KCNQ1-Kaliumkanal als ein zellulärer Spannungssensor wirken kann, der bioelektrische Signale aus der Umgebung der Stammzellen in spezifisches Verhalten der Zellen übersetzt“, so Seebohm.
Neue Ansatzpunkte für Therapien
Die Bedeutung bioelektrischer Signale ist noch weitgehend unverstanden. „Das Verständnis der Regulation von embryonalen Stammzellen durch biophysikalische Eigenschaften der Plasmamembran und der Ionenflüsse wird neue Marker und Kontrollpunkte für biomedizinische Eingriffe hervorbringen“, schätzt der Biochemiker.
Der neu entdeckte Mechanismus könnte von Bedeutung bei menschlichen Krankheiten wie Metaplasie, Krebs und Neuralleistendefekten sein. Substanzen, die Kaliumkanäle beeinflussen, könnten daher eine neue Bedeutung bei der Behandlung dieser Krankheiten erlangen.
(idw – Ruhr-Universität Bochum, 15.10.2008 – DLO)