Molche können ihre Beine bei Verlust nachwachsen lassen, und auch ein verletztes Herz wird vollständig wiederhergestellt. Wissenschaftler haben nun begonnen, die zellulären Mechanismen dieser beeindruckenden Regenerationsleistung zu entschlüsseln und sind auf eine bemerkenswerte Plastizität von Molch-Herzzellen gestoßen. Da Säugetieren – und damit auch Menschen – diese Fähigkeiten fehlen, könnten die Erkenntnisse zur Entwicklung neuer Zelltherapien für Patienten mit geschädigten Organen beitragen.
Notophthalmus viridescens, Grünlicher Wassermolch, heißt eines der Lieblingstiere der Forscher um Thomas Braun vom Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim. Die Amphibie ist eigentlich in den Feuchtgebieten Nordamerikas beheimatet, fühlt sich aber auch in den Aquarien des Instituts recht wohl. Für die Wissenschaftler ist dieses kleine Tier besonderes interessant: Denn während beim Menschen ein beispielsweise durch Herzinfarkt geschädigter Herzmuskel nicht ausreichend regenerieren kann, sondern das zerstörte Muskelgewebe stattdessen vernarbt, wird das Molchherz nach einer Schädigung vollständig repariert und die Funktion des Organs zu hundert Prozent wieder hergestellt.
Wiederherstellung der Herzfunktion in 14 Tagen
Der Schlüssel zu dieser Regenerationsfähigkeit sind die Herzmuskelzellen selbst. Die Zellen im Molchherz sind nach einer Schädigung des Organs in der Lage, ihre charakteristischen Eigenschaften aufzugeben, sich zu dedifferenzieren. Dabei werden – das konnten die Forscher zeigen – typische Proteine von Herzmuskelzellen, die schwere Myosinkette und verschiedener Troponine, dramatisch herunterreguliert.
Gleichzeitig beginnen die Zellen, sich massiv zu teilen und so neue Herzmuskelmasse aufzubauen. Die Wiederherstellung der Herzfunktion dauert beim Molch rund zwei Wochen. Die Daten zeigen, dass zu diesem Zeitpunkt die Expression der muskelspezifischen Proteine wieder normal ist, das heißt die Zellen haben sich wieder differenziert, also ihre charakteristischen Eigenschaften zurück gewonnen.
Die Forscher isolierten die Herzmuskelzellen und nahmen sie in Kultur. Bei einem Großteil der Zellen konnten Braun und seine Mitarbeiter ein Protein namens Phospho-H3 nachweisen. Dieses Protein ist ein Marker für die G2-Phase des Zellzyklus und ein Hinweis darauf, dass die Herzregeneration beim Molch ohne die Beteiligung von Stammzellen abläuft. Auch bildet sich bei der Herzregeneration augenscheinlich kein typisches Wundheilungsgewebe aus, das als Blastem bezeichnet wird.
"Das Herz besitzt nur eine relativ kleine Anzahl verschiedener Zelltypen. Dies könnte ein Grund sein, weshalb für den Wiederaufbau von Herzgewebe kein Blastem notwendig ist.", erklärt Braun diesen Befund in der aktuellen Ausgabe der Fachzeitschrift Journal of Cell Science. Auch haben die Bad Nauheimer Forscher keine Hinweise für die Beteiligung von Stammzellen an der Herzreparatur in Molchen gefunden.
Neue Erkenntnisse zur Reparatur geschädigter menschlicher Herzen
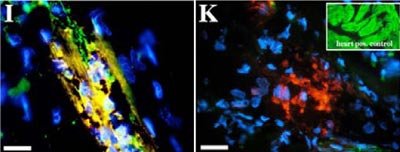
Anders sehen die Abläufe bei der Regeneration verloren gegangener Extremitäten aus: Hier entwickeln die Molche – im Unterschied zum Herzen – ein Blastem. Blastemzellen haben gewisse Charakteristika, wie zum Beispiel die Ausbildung verschiedener Zelltypen mit Stammzellen gemein. Die Zellbiologen injizierten nun isolierte Herzmuskelzellen in ein nach Amputation neu auswachsendes Molchbein. In diesem Umfeld begannen sich die Zellen, wie beim Herzen, zu dedifferenzieren; bei einer Injektion in eine ungeschädigte Extremität taten sie dies nicht. Und wiederum registrierten die Forscher innerhalb kürzester Zeit den Verlust von herzmuskelspezifischen Proteinen.
Gleichzeitig wurde nun aber die Expression von Proteinen eingeleitet, die charakteristisch für Blastemzellen sind, wie das Marker-Protein 22/8. Rund 15 Tage nach ihrer Transplantation in das Molchbein hatten sich die Zellen zu Skelettmuskelzellen differenziert und herzmuskeltypische Marker waren verloren gegangen.
"Wir vermuten, dass das Signal für die Dedifferenzierung von Zellen des Wundheilungsgebietes ausgeht und die Zellen untereinander kommunizieren", erklärt Braun. Solche Signale könnten beispielsweise durch bestimmte Enzyme vermittelt werden. Ein solches Enzym – die focal adhesion kinase -, die an der Übertragung von Signalen in die Zelle beteiligt ist, ist nämlich bei den transplantierten Zellen phosphoryliert und damit aktiv. Die Forscher hoffen, dass sich mit einem tieferen Verständnis der molekularen Zusammenhänge der Regeneration beim Molch neue Wege für die Reparatur geschädigter Herzen beim Patienten eröffnen.
(idw – MPG, 09.11.2006 – DLO)