Ob bei der Immunabwehr oder dem Wachstum von Geweben: Das Aneinanderhaften von Zellen ist wichtig für viele Lebens- und Krankheitsvorgänge. Ausgelöst wird diese so genannte Zelladhäsion von speziellen Molekülen auf den Zelloberflächen. Einige dieser Adhäsionsmoleküle können von den Zellen „an“ und „aus“ gestellt werden. Forscher haben jetzt mit Hilfe eines theoretischen Modells nachgewiesen, dass die charakteristischen Zeiten, in denen die Adhäsionsmoleküle zwischen aktiven und inaktiven räumlichen Strukturen hin- und hergeschaltet werden, einen starken Einfluss auf die Adhäsion haben.
{1l}
Zellen haften an anderen Zellen mit Hilfe von Adhäsionsmolekülen, die sich an den Zelloberflächen befinden. Jedes Adhäsionsmolekül einer Zelle bindet dabei ein „Partnermolekül“ einer anderen Zelle. Die beiden Bindungspartner sind entweder identisch – wie zwei Hände, die sich gegenseitig halten – oder voneinander verschiedene Moleküle, die zueinander passen wie Schloss und Schlüssel. Cadherine beispielsweise sind Adhäsionsmoleküle, die häufig identische Cadherine binden und dadurch die Adhäsion gleicher Zellen beim Wachstum und der Regeneration von Körpergeweben bewirken. Integrine und Selektine dagegen binden verschiedenartige Adhäsionsmoleküle, etwa bei der Adhäsion von Leukozyten während der Immunabwehr.
Balance zwischen Anziehung und Abstoßung
Entscheidend für die Adhäsion zweier Zellen ist das Wechselspiel zwischen der Anziehung der Adhäsionsmoleküle und den abstoßenden Kräften, die von Fluktuationen der Zellmembranen und von großen, nicht adhäsiven Molekülen auf den Zelloberflächen herrühren. In einem gesunden Organismus haben Zellen die Kontrolle über die Balance zwischen Anziehung und Abstoßung. Bei einigen Krebsarten führen Mutationen der Adhäsionsmoleküle jedoch zu einer die Störung des Gleichgewichts und damit zu anomaler Zelladhäsion und dem Wachstum von Tumoren.
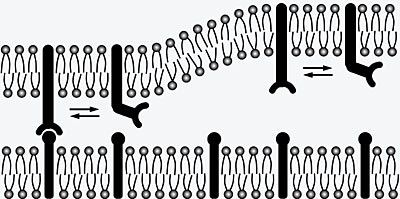
Zellen können ihre Adhäsionsstärke über die Konzentrationen der Adhäsionsmoleküle auf den Zelloberflächen regulieren. Bei manchen Zellen erfolgt diese Regulation jedoch nicht nur über die Molekülkonzentrationen, sondern auch durch Adhäsionsmoleküle, die verschiedene Konformationszustände, also unterschiedliche dreidimensionale Strukturen, besitzen. Integrine beispielsweise können mindestens zwei unterschiedliche Zustände annehmen: In gestreckter Konformation sind sie aktiv und binden an Partnermoleküle auf anderen Zelloberflächen, in der gefalteten Konformation hingegen inaktiv.
Die Forscher des Max-Planck-Institutes für Kolloid- und Grenzflächenforschung haben jetzt gezeigt, dass die charakteristischen Zeiten, in denen die Adhäsionsmoleküle zwischen ihren verschiedenen Konformationen hin- und hergeschaltet werden, einen starken Einfluss auf die Adhäsion haben. Der Schaltprozess eines Adhäsionsmoleküls zwischen aktivem und inaktivem Zustand ist ein stochastischer Prozess, also ein Prozess, der mit einer gewissen Wahrscheinlichkeit zu einer bestimmten Zeit auftritt. Dieser Schaltprozess kann durch die mittleren Zeiten für die Schaltübergänge in den beiden Richtungen (von aktiv zu inaktiv und umgekehrt) charakterisiert werden. Der Schaltvorgang erfordert zumindest in einer der Richtungen Energie, beispielsweise in Form von ATP-Molekülen.
Resonanz verringert Adhäsionsstärke
Die Max-Planck-Wissenschaftler aus Potsdam haben die Adhäsion von Membranen mit schaltbaren Adhäsionsmolekülen theoretisch untersucht. Die beiden sich gegenüberstehenden Kräfte bei der Adhäsion dieser Membranen sind die anziehenden Kräfte der Adhäsionsmoleküle und abstoßende Kräfte, die von den Formfluktutationen der Membranen herrühren. Beide Kräfte haben charakteristische Zeitskalen. Diese Zeitskalen sind die Schaltzeiten der Adhäsionsmoleküle sowie die Relaxationszeiten der Membranfluktuationen. Wie die Forscher in der Fachzeitschrift Physical Review Letters berichten, tritt interessanterweise ein Resonanzeffekt auf, wenn sich diese Zeiten gleichen. Die Resonanz führt zu starken Membranfluktuationen und zu einer deutlichen Verringerung der Adhäsionsstärke.
Dieser Resonanzeffekt könnte nun dazu benutzt werden, die Zelladhäsion auf biomimetischen Oberflächen zu kontrollieren. In den letzten Jahren haben Wissenschaftler synthetische Moleküle entwickelt, die man mit Hilfe von Licht zwischen den verschiedenen Zuständen hin und her schalten kann. Die charakteristischen Schaltzeiten der Moleküle hängen dabei von der Lichtintensität ab. Werden die Moleküle auf einem Substrat verankert, so entsteht eine optisch schaltbare Oberfläche, mit der man das Adhäsionsverhalten von Zellen beeinflussen und untersuchen kann.
(idw – MPG, 02.03.2006 – DLO)