Anfang 1913 steht Niels Bohr vor mehr Fragezeichen als Antworten: Rutherfords Atommodell kann nicht erklären, warum die Elektronen in der Hülle nicht ständig Strahlung aussenden. Und warum die Elemente scharf abgegrenzte Spektrallinien aussenden ist ebenfalls völlig schleierhaft. Doch der junge Physiker hat einen Geistesblitz: Was wäre, wenn auch in der Welt der kleinsten Teilchen nicht die klassische Elektrodynamik gilt, sondern die gerade erst postulierten Quanten? Bohr beginnt, die Planckschen Prinzipien auf die Balmer-Serie des Wasserstoffs anzuwenden und stellt überraschende Parallelen fest.
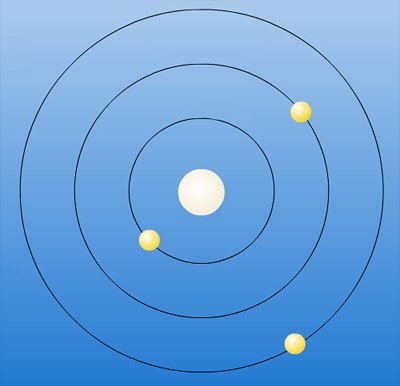
Wie Planeten auf ihren Bahnen um die Sonne
Nach und nach kristallisiert sich ein völlig neues Bild des Atoms und seiner Elektronen heraus: Demnach kreisen die Elektronen nicht einfach ungeordnet und in beliebigem Abstand um den Atomkern, sondern in bestimmten Bahnen. „In diesem Bild sehen wir sofort eine erstaunliche Ähnlichkeit zu einem Planetensystem“, erklärt Bohr. Innerhalb dieser Bahnen befinden sich die Elektronen in einem stabilen Zustand, sie verlieren keine Energie und senden auch keine Strahlung aus. Ihre Bewegung steht in einem Gleichgewicht zur Kraft, die der Kern auf sie ausübt.
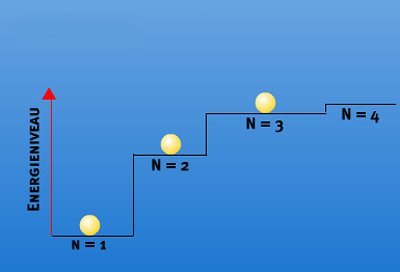
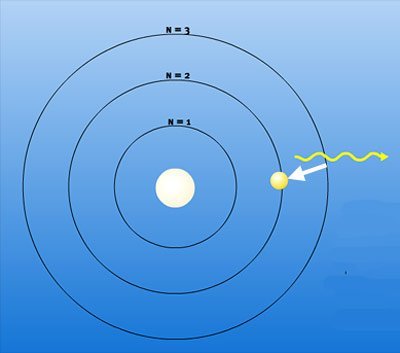
Anders aber, wenn beispielsweise dem Wasserstoffatom Energie zugeführt wird: Dann nimmt das Elektron diese Energie auf und wird dadurch von seinem Grundzustand auf eine weiter außen liegende – energiereichere – Bahn katapultiert. Nach einiger Zeit aber fällt es wieder in seinen ursprünglichen Zustand zurück. Die nun überschüssige Zusatzenergie gibt das Elektron dabei ab – als Strahlung. Und hier sieht Bohr die Erklärung für die Spektrallinien und die Verbindung zu Planck:
Energiepakete auch beim Elektron
„Der essenzielle Punkt in Plancks Theorie der Strahlung ist es, dass die von einem Atomsystem ausgesendete Energie nicht kontinuierlich erfolgt, sondern im Gegenteil in klar getrennten Emissionen“, erklärt der Physiker. Und weil das Elektron seine Energie nur in bestimmten Paketen – den Quanten – abgeben kann, hat der abgegebene Lichtblitz immer eine feste Wellenlänge, entsprechend der abgegebenen Energiemenge. Statt eines allmählichen Übergangs sieht man dieses Lichtsignal im Spektrum daher als klar abgrenzte Linie.
Nun wird auch die Balmer-Serie des Wasserstoffs klar: Wenn das Elektron des Wasserstoffs je nach Energiezufuhr auf unterschiedlich weit außen liegende Bahnen katapultiert wird, fällt es bis zum energieärmsten Grundzustand jeweils unterschiedlich weit. Als Folge gibt es jeweils unterschiedliche Strahlenpakete ab – und diese erzeugen die verschiedenen Linien der Balmer-Serie.
Nadja Podbregar
Stand: 21.06.2013