Sie stecken in Handys, Notebooks und Kameras, aber auch in Elektroautos oder der Elektronik von Flugzeugen: Lithiumionen-Akkus bilden die Grundlage fast aller mobilen Stromspeicher der modernen Technikwelt. Denn diese Akkumulatoren sind leicht, besitzen aber trotzdem eine relativ hohe Energiedichte und können unzählige Male auf- und wieder entladen werden.
So funktioniert der Akku
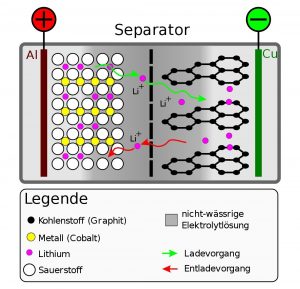
Das Prinzip der gängigen Lithium-Ionen-Akkus ist einfach: Sie bestehen aus zwei Elektroden, zwischen denen Lithium-Ionen beim Laden oder Entladen hin- und herwandern. Die Anode – der Pluspol der Batterie – besteht meist aus Graphit, die Kathode aus Metalloxiden wie Lithium-Kobaltoxid. In die meist poröse Struktur dieser Materialien lagern sich die Lithiumionen beim Laden oder Entladen reversibel ein. Die beiden Elektroden sind durch eine Trennwand getrennt, die nur Lithiumionen durchlässt.
Entscheidend für die Eignung eines Materials als Elektrode ist dabei sowohl seine Struktur wie auch sein Reaktionsverhalten. So darf es seine Form und Größe bei der Aufnahme der Ionen nicht wesentlich verändern. Zudem müssen sich die Ionen gut in das Material hinein und wieder hinaus bewegen können – erst das macht den Akku schnell und effektiv be- und entladbar. Beim Entladen des Akkus bewegen sich die Lithium-Ionen von der Graphit-Anode zur Kathode. Die dabei freiwerdenden Elektronen fließen über den externen Stromkreis ab. Beim Laden werden wieder Elektronen zugeführt und die Ionen wandern zurück zur Anode – der Zyklus kann erneut beginnen.
Der dritte Akteur im Bunde ist der Elektrolyt: Er liefert Lithium-Ionen und bildet gleichzeitig die Matrix, durch die die Ionen von einer Elektrode zur anderen wandern. Die Ansprüche an ihn sind hoch, denn er muss leitfähig sein, eine hohe Spannung aushalten und über eine längere Zeit elektrochemisch und thermisch stabil bleiben. In gängigen Akkus werden meist in organischen Lösungsmitteln gelöste Lithiumverbindungen eingesetzt.














