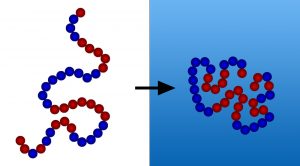
Die Faltung der Aminosäurekette kann eine ziemlich komplizierte Angelegenheit sein. Zum Glück müssen die Proteine da nicht alleine durch, sondern bekommen Hilfe dabei, ihre Aminosäureketten auf die richtige Art und Weise zu verknoten. Diese Hilfe kommt in Form von Hitzeschockproteinen, bekannt als Chaperone, die in allen Zelltypen vorkommen.
Chaperone verhindern ein Kuddelmuddel beim Falten
Chaperon ist ein französischen Begriff für „Anstandsdame“. Während früher die Anstandsdamen darauf achteten, dass unverheiratete Mädchen anständig blieben, passen sie in unseren Zellen darauf auf, dass Proteine im Reifungsprozess während der Faltung keinen schädlichen Einflüssen unterliegen und korrigieren ihre Faltungsfehler.
Die wichtigste Aufgabe der Chaperone ist es, Proteine vor einer Aggregation, also einer Akkumulierung und Verklumpung von falsch gefalteten Aminosäureketten, zu bewahren. Der Hauptauslöser für eine solche Aggregation ist die Interaktion von hydrophoben Seitenketten verschiedener Proteine, die aufgrund des ungefalteten Zustands noch nicht im Inneren des Proteins verborgen liegen.
Benimmkurse in der Zelle
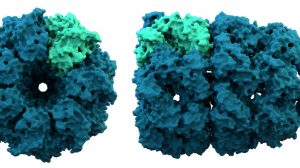
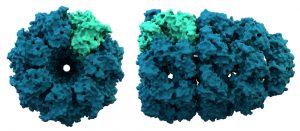
Auch Chaperone könnten ihre Arbeit jedoch nicht machen, wäre da nicht ihre spezielle räumliche Struktur. Die zylindrischen Chaperonine, einer der wichtigsten Bestandteile des Chaperon-Systems, bilden käfigartige Strukturen. In einer innenliegenden Kammer schließen sie das noch ungefaltete Protein ein. Damit wird das Protein vor Störfaktoren geschützt und ein Raum geschaffen, indem eine Aggregation mit anderen ungefalteten Proteinen verhindert wird. Die wichtigste Funktion dieser Hohlzylinder ist dabei, die exponierten hydrophoben Aminosäuren vor anderen Proteinen abzuschirmen.