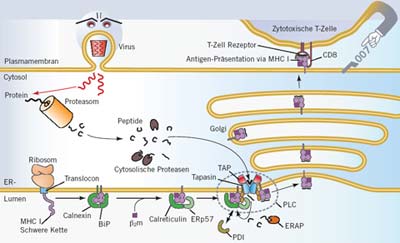
Das in jeder Zelle neu hergestellte Molekül MHC I trifft sich im so genannten Endoplasmatischen Retikulum (ER) mit seinen beiden „Helfern“, den Chaperonen BiP (von engl. binding protein) und Clanexin (Cnx). Im nächsten Schritt er folgen neben der Anlagerung des MHC-Bestandteils β-2-Mikroglobulin (β2m) die Abspaltung von BiP sowie das Ersetzen von Calnexin durch das lösliche Protein Calreticulin (Crt). Die Disulfid-Isomerase ERp57 (von engl. endoplasmatic reticulum protein) lagert sich ebenso wie das lösliche Protein Tapasin an den Komplex an.
Schließlich wird die Bildung des so genannten Peptidbeladungskomplexes (PLC, engl. peptide loading complex) durch die Bindung vom Transporter assoziiert mit Antigenprozessierung (TAP) vervollständigt.
Viren als klassische Bösewichte
Peptide in der Zelle, die durch proteasomalen Abbau generiert werden, gelangen mithilfe des Transporters TAP nun ins ER, wo sie auf das MHC-I-Molekül geladen werden. Das Zusammenspiel der verschiedenen Komponenten des Peptidbeladungskomplexes ist dabei vonnöten. Zu lange Peptide werden bei diesem Prozess durch die Aminopeptideasen ERAP1 und -2 prozessiert. Das Resultat ist ein stabiler Peptid-MHC-I-Komplex, der den sekretorischen Weg bis zur Zelloberfläche beschreitet, wo er durch die T-Killerzelle (alias Bond) inspiziert werden kann (rechts oben).
Viren, die als klassische Bösewichte die Zelle befallen (links oben), werden, nachdem sie die Zelle produktiv befallen haben, zwangsläufig über MHCI in Form von Virus-abgeleiteten Peptiden präsentiert und versuchen der Erkennung durch Angriffe gegen TAP und andere Bestandteile des Peptidbeladungskomplexes zu entgehen.
Daphne Nikles und Robert Tampé / Forschung Frankfurt
Stand: 23.10.2009