So allgegenwärtig Moleküle und damit chemische Bindungen sind – zwischen ihnen gibt es feine, aber entscheidende Unterschiede. Denn wie die Elektronenaustausch abläuft, hängt von den Umständen und vom Reaktionspartner ab. Und in sehr vielen Fällen kommt es statt eines Entweder- Oder zu einer Kompromisslösung: Zwei Atome teilen sich gütlich ihre Außenelektronen.
Ionenbindung: Anziehendes Gitter
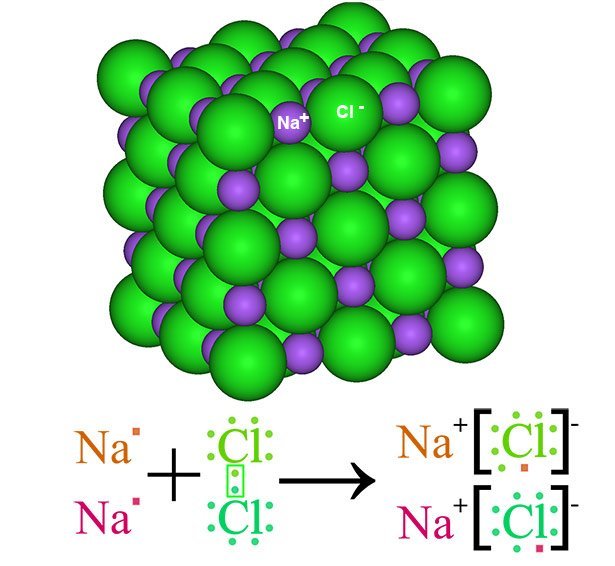
Je nach Art des Elektronenaustauschs unterscheidet man heute drei Haupttypen der chemischen Bindung. Der erste ist die Ionenbindung zwischen einem Metall und einem Nichtmetall. Dabei herrschen klare Verhältnisse: Das Metall gibt seine Außenelektronen vollständig an den Partner ab und wird so zu einem positiv geladenen Kation. Das Nichtmetall nimmt die Valenzelektronen auf und wird zum negativ geladenen Anion.
Weil sich die gegensätzlichen Ladungen beider Ionen anziehen, entsteht dabei ein relativ stabiles Gitter – ein Salz. Beim Kochsalz (NaCl) beispielsweise wechseln sich im Salzkristall positiv geladene Natrium- und negativ geladene Chloridionen ab und stabilisieren das Gitter dadurch. Salze haben wegen ihrer hohen Bindungsenergie oft einen relativ hohen Schmelzpunkt, dafür sind sie aber ziemlich spröde.
Kovalente Bindung: Geteilte Elektronenpaare
Anders ist dies bei der Reaktion von Nichtmetallen untereinander: Sie „teilen“ sich ihre Valenzelektronen und bilden bindende Elektronenpaare. Bei dieser kovalenten Bindung entstehen aus ursprünglich getrennten Elektronenorbitalen ein oder mehrere gemeinsame Molekülorbitale. Diese Bindungsform ist bei organischen Molekülen die Regel, aber auch bei vielen molekularen Gasen. Die Art und Menge der an der Bindung beteiligten Elektronenorbitale ist für die Form und Eigenschaften des entstehenden Moleküls entscheidend.
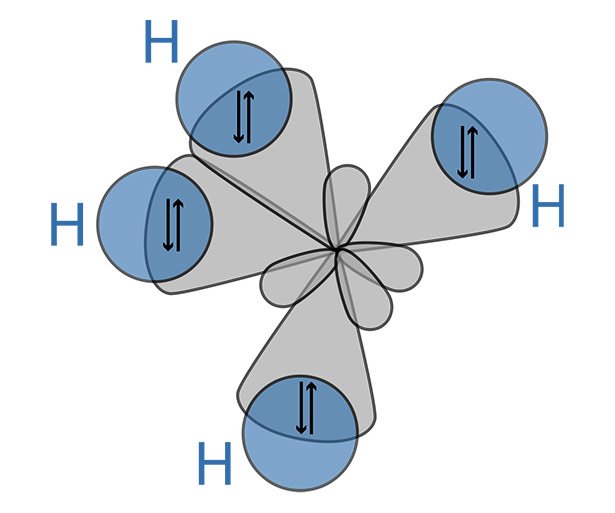
So besitzt das Kohlenstoffatom vier Außenelektronen verteilt auf ein kugelförmiges s-Orbital und drei p-Orbitale. Reagiert der Kohlenstoff nun mit vier Wasserstoffatomen zu Methan (CH4), wandeln sich diese Orbitale in vier gleiche sp3-Hydridorbitale um. Diese keulenförmigen Aufenthaltszonen ordnen sich im Winkel von 109 Grad zueinander an und bilden so einen Tetraeder. Jedes dieser Hydridorbitale verschmilzt mit dem kugelförmigen Elektronenorbital eines Wasserstoffatoms. Es entstehen so Zonen erhöhter Elektronendichte, die die Atomkerne beider Partner stärker voneinander abschirmen und die Bindung so stabilisieren.
Metallbindung: Ein „See aus Elektronen“
Die dritte Bindungsform ist die Metallbindung – die Bindung, die Metallatome untereinander eingehen. Die Metallatome geben dabei Valenzelektronen ab, diese bewegen sich aber frei in dem von den Atomrümpfen gebildeten Metallgitter. Dieser „See aus Elektronen“ macht Metalle besonders leitfähig für Strom und Wärme. Er verleiht Metallen wie Silber oder Gold zudem ihren typischen Glanz und auch ihre Formbarkeit.
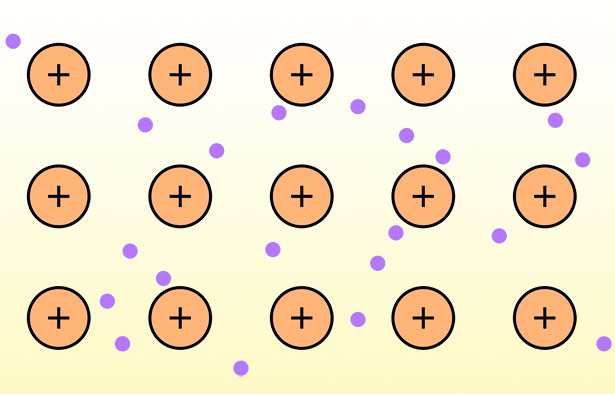
Die Eigenheiten der Metallbindung erklären auch, warum beispielsweise Eisen beim Rosten seinen Glanz verliert. Oder warum Silber und Kupfer beim Anlaufen unansehnlich stumpf werden. Hinter diesem Wandel steckt eine chemische Reaktion, bei der die Metalle oxidiert werden. Das aber bedeutet, dass die Metallatome nun eine ionische Bindung mit Sauerstoff eingehen und ihre zuvor frei umherfliegenden Elektronen an den Bindungspartner abgeben. Als Folge verschwindet auch der „Elektronensee“, der durch Reflektion des Lichts für den Glanz gesorgt hat – das Metall wird zum stumpfen und spröden Metalloxid.
Die Tücke liegt im Detail
Doch so fein säuberlich getrennt diese Bindungstypen scheinen – die Übergänge sind fließend. Je nach Bindungspartner können auch Ionenbindungen zwischen Metallen und Nichtmetallen kovalente Anteile aufweisen und umgekehrt. Und auch vermeintlich typische Eigenschaften führen manchmal in die Irre: Der Diamant besitzt wie viele Salze einen hohen Schmelzpunkt und ist transparent, trotzdem besteht er aus rein kovalenten Bindungen zwischen Kohlenstoffatomen.
Um herauszufinden, welche Bindung in einem Molekül vorliegt, müssen Chemiker bis auf die Atomebene hinabtauchen. Denn erst die Kombination von Bindungsenergie, Bindungslänge und der geometrischen Anordnung der Bindungspartner verrät letztlich, welchen Charakter eine „Paarung“ von Atomen hat.
Doch diese Merkmale zu ermitteln, ist alles andere als einfach. Bei kristallinen Verbindungen und komplexen organischen Molekülen liefert die Röntgenbeugung Hinweise auf die atomare Struktur im Kristallgitter. Bei Flüssigkeiten oder Gasen müssen Chemiker auf spektroskopische Methoden zurückgreifen. Die Linien im Laser- oder Röntgenspektrum erlauben dann Rückschlüsse auf die Elektronenkonfiguration und die Energieniveaus im Molekül – und damit auch auf die Bindungen.
Nadja Podbregar
Stand: 12.10.2018