Die bisherigen Erfahrungen und Misserfolge bei der Kunstblut-Entwicklung unterstreichen, wie schwer unser Blut nachzuahmen oder zu ersetzen ist. Trotz aller Fortschritte in der Medizin und Biotechnologie ist dieses geniale Patent der Natur bisher unverzichtbar. Unter anderem deshalb suchen einige Forscherteams inzwischen nach einem anderen Weg, den Mangel an geeignetem Spenderblut zumindest zu verringern.
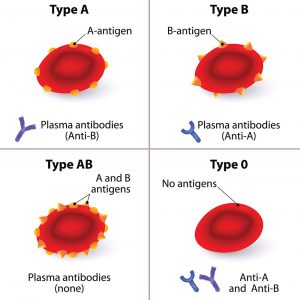
Ihr Ansatzpunkt ist die Tatsache, dass längst nicht jede Blutspende für jeden Empfänger geeignet ist. Eine Transfusion ist nur dann ohne Komplikationen möglich, wenn die Blutgruppe stimmt und die roten Blutkörperchen auf ihrer Oberfläche die passenden Moleküle tragen. Noch besser ist es allerdings, wenn diese Erkennungsmarker ganz fehlen, weil dann das Immunsystem des Empfängers das transfundierte Blut gar nicht erst als fremd erkennt.
Zuckerscheren gegen Blutgruppen-Antigene
An dieser Stelle setzen Wissenschaftler an, um ein universelles Spenderblut zu erzeugen: Sie suchen nach Methoden, mit denen sich die störenden Zucker und Proteinaufsätze der roten Blutkörperchen nach der Spende entfernen lassen. Bereits 2018 entdeckten Forscher um Stephen Withers von der University of British Columbia in einem Darmbakterium einige Enzyme, die gezielt die Blutgruppen-Antigene A und B abschneiden.
„Wenn man diese Antigene entfernt, die nur aus einfachen Zuckern bestehen, dann kann man Blut der Gruppe A oder B in die Blutgruppe Null umwandeln“, erklärt Withers. Damit hätte man ein zumindest im AB0-System als universell geltendes Spenderblut. 2019 identifizierten Forscher derselben Universität zwei weitere Enzyme, die noch effizienter arbeiten. Allerdings: Ob diese „Umwandlung“ von Spenderblut auch praktisch funktioniert und ob der Aufwand finanziell lohnend wäre, ist noch offen.