Wie bedeutsam die Katalyse für die Chemie ist, beweist ein Blick nach Stockholm. Insgesamt zehn Chemie-Nobelpreise gab es seit 1909 für die Katalyseforschung im engeren Sinne. Unter den Preisträgern waren so bekannte Chemiker wie Fritz Haber und Carl Bosch. Sechs der zehn Nobelpreise für Katalyse wurden erst seit dem Jahr 2000 vergeben – das demonstriert, wie „heiß“ dieses Forschungsgebiet noch immer ist.

Die letzten in der illustren Reihe der Nobelpreisträger waren im Jahr 2021 Benjamin List vom Max-Planck-Institut für Kohlenforschung in Mülheim und David MacMillan von der University of California in Berkeley. Sie erhielten den renommierten Preis „für die Entwicklung asymmetrischer Organokatalysatoren“. Um die Jahrtausendwende herum hatten beide Forscher, unabhängig voneinander, die Tür zu diesem neuen Spezialgebiet der Katalyse aufgestoßen.
Die asymmetrische Organokatalyse
Von Organokatalyse sprechen Chemiker, wenn es sich bei den Katalysatoren um organische Moleküle handelt. Dass diese chemische Reaktionen beschleunigen können, ist lange bekannt. Schon Justus von Liebig machte vor bald 200 Jahren davon Gebrauch, als er unter anderem für die Bildung aromatischer α-Hydroxyketone Cyanid als Katalysator einsetzte oder später den katalytischen Effekt von Acetaldehyd auf eine andere Synthese entdeckte.
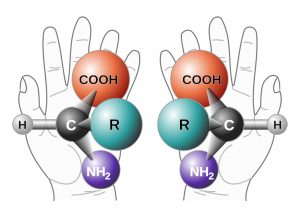
Neu an den Arbeiten von List und MacMillan war aber die asymmetrische Synthese mit organischen Katalysatoren. Mit „asymmetrisch“ sind Reaktionen gemeint, die selektiv nur zu einem von zwei möglichen Enantiomeren führen. Diese Spiegelbildisomer-Paare gibt es zum Beispiel dann, wenn ein Molekül ein Stereozentrum enthält. Synthesen, die selektiv vor allem zu einem Enantiomer führen, sind häufig bei Substanzen gefragt, die in biologischen Systemen eingesetzt werden sollen, also zum Beispiel bei Medikamenten, Mitteln für die Schädlingsbekämpfung oder auch bei Duft- und Aromastoffen.