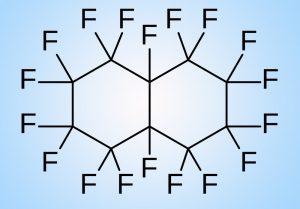
Neben Kunstblut auf Basis von Hämoglobin gibt es noch einen zweiten Ansatz für die Versorgung von Organen und Geweben mit Sauerstoff. Dieser ist weder von der Natur abgeschaut noch versucht er, Blut oder Blutkörperchen nachzuahmen. Stattdessen bildet eine Stoffklasse die Grundlage, die auf den ersten Blick völlig abwegig erscheint: Perfluorcarbone (PFC) – Kettenmoleküle aus Kohlenstoff und Fluor.

Ein kohlenstoffbasierter Sauerstofftransporter
Den Anstoß dafür gab ein Versuch, den der US-Biochemiker Leland Clark bereits in den 1960er Jahren durchführte: Er tauchte Nagetiere in einen Behälter mit flüssigem Perfluorcarbon – und sie überlebten. Dieser Versuch bewies, dass Säugetiere diese transparente Flüssigkeit statt Luft einatmen können und trotzdem überleben. Clarks Experiment war der Impulsgeber für eine jahrzehntelange Forschung zur Flüssigkeitsbeatmung, aber auch für Versuche zu künstlichem Blut.
Perfluorcarbone sind deswegen dafür so geeignet, weil sie große Mengen an Sauerstoff aufnehmen können – mehr als Hämoglobin. Gleichzeitig besitzen sie eine geringe Oberflächenspannung und können daher beispielsweise Lungenbläschen gut benetzen, wodurch ein Sauerstoffaustausch möglich wird. Weil diese Moleküle zudem chemisch inert sind und nicht mit unseren Zellen oder Geweben reagieren, sind sie ungiftig.
Von der Flüssigbeatmung zum Kunstblut
Tatsächlich hat es bereits in den 1990er Jahren Versuche gegeben, frühgeborene Kinder mit einer Perfluorcarbon-Lösung zu beatmen. Weil bei ihnen die Lungen oft nicht fertig ausgebildet ist, sollte diese Flüssigkeitsbeatmung die zarten Lungenbläschen schonen und die Kinder so vor Lungenschäden bewahren. Allerdings ist die praktische Anwendung dieser Verfahren so kompliziert und gefahrenträchtig, dass dies inzwischen weitgehend aufgegeben wurde.