Obwohl sie aus ordinärem Kohlenstoff bestehen, gelten sie als unvergänglich, widerstehen enormen Drücken und durchschneiden selbst Gestein, Glas oder Stahl: Diamanten sind das härteste natürlich entstandene Material, sie erreichen den maximalen Wert 10 auf der Mohschen Härteskala. Das spiegelt auch ihr Name wider: Der Begriff Diamant leitet sich von griechischen Wort „adamas“ ab – unbezwingbar.
Kompaktes Gitter und stabile Bindungen
Doch was steckt hinter der ungewöhnlichen Widerstandsfähigkeit dieser Edelsteine? Schließlich sind sie nichts weiter als gewöhnlicher Kohlenstoff und bestehen damit aus dem gleichen Element wie der weiche, abreibbare Graphit, Holzkohle oder das aus nur einer Atomlage bestehende Graphen. Allen gemeinsam ist, dass ihre Kohlenstoffatome vier Außenelektronen besitzen und mit bis zu vier Partnern kovalente Bindungen eingehen können. Bei einer solchen Bindung kommt es zu Wechselwirkungen zwischen den Elektronen der beteiligten Atome, durch die die Orbitale der Elektronen verschmelzen und gemeinsame Hybridorbitale entstehen.
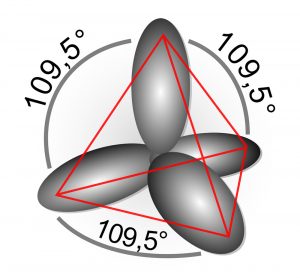
Weil ein Diamant unter extremem Druck und hohen Temperaturen entstanden ist, bilden seine Kohlenstoffatome besonders kompakte und stabile Bindungen zu ihren Nachbarn aus. Es entsteht ein kubisches Kristallgitter, in dem jedes Kohlenstoffatom über vier längliche sp3-Hybridorbitale mit vier benachbarten Kohlenstoffatomen verbunden ist. Die Bindungen formen ein Tetraeder, in dessen Zentrum der Atomkern liegt.
Hochdruck, Härte und Hitzebeständigkeit
Die Kombination aus hoher Bindungsenergie zwischen den Kohlenstoffatomen und der kompakten Gitterstruktur macht den Diamanten so widerstandsfähig. Sein Kristallgitter bleibt selbst bei einem extremen Druck von hunderten Gigapascal stabil und widersteht der Verformung. Deswegen nutzen Wissenschaftler Diamant-Stempelzellen, wenn sie in Hochdruckexperimenten beispielsweise die Bedingungen im Erdkern oder im Inneren anderer Planeten nachbilden wollen.













