Alle Elemente sind gleich, aber einige sind gleicher: Schon vor der Karlsruher Konferenz von 1860 haben viele Chemiker erkannt, dass es eine Art Verwandtschaft zwischen bestimmten Elementen zu geben scheint. So sind Chlor, Brom und Iod alle drei gasförmig oder leicht flüchtig, dabei intensiv gefärbt und extrem reaktionsfreudig, mit Metallen und Wasserstoff. Andere, wie Lithium, Natrium und Kalium sind dagegen fest und reagieren stark mit Wasser.

Aber auch innerhalb dieser Verwandtschaftsgruppen gibt es offensichtliche Unterschiede: „Lithium wandert gemächlich über die Wasseroberfläche, reagiert mit ihm und gibt Wasserstoff ab, bis es verschwunden ist. Ein Klumpen Natrium aber bewegt sich mit wütendem Hissen über die Oberfläche, fängt aber kein Feuer. Kalium dagegen fängt Feuer in dem Moment, indem es das Wasser berührt, brennt mit einer blasslila Flamme und verspritzt Kügelchen von sich selbst überall“, so beschreibt der Neurowissenschaftler Oliver Sacks, wie er als Jugendlicher seine ersten chemischen Erkundungen solcher „unterschiedlichen Ähnlichkeiten“ erlebte.
Das Geheimnis der Triaden
Diese Ähnlichkeiten erkennt 1829 auch der deutsche Chemiker Johann Döbereiner. Und er erkennt auch, dass die Atomgewichte für diese Verwandtschaften eine Rolle zu spielen scheinen: Wenn er die sich gleichenden Elemente Calcium, Strontium und Barium nebeneinander stellt, dann entspricht das Atomgewicht von Strontium genau dem Mittelwert der beiden anderen. Genauso bei einem weiteren Trio: Lithium, Natrium und Kalium. Immerhin 30 von den zu seiner Zeit bekannten 53 Elementen kann Döbereiner mit seinem „Gesetz der Triaden“ zu Gruppen ordnen. Die restlichen Elemente, darunter auch die Gase Sauerstoff, Wasserstoff und Stickstoff, verweigern sich seinem System jedoch. Und seine Zeitgenossen ebenfalls. Ihnen ist das Ganze nicht schlüssig genug.
Die Musik der Elemente: Das Gesetz der Oktaven
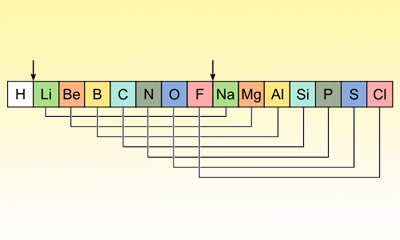
35 Jahre später und gestärkt durch die in Karlsruhe „aufgeräumten“ Atomgewichte, versucht sich der englische Chemiker John Reina Newlands ebenfalls an einer Sortierung. Er reiht zunächst die bekannten Elemente nach größer werdender Atommasse auf. Schnell erkennt er, dass die Eigenschaften der Elemente in dieser Reihung ein Muster zeigen: Nach jedem achten Element wiederholen sich die grundlegenden Eigenschaften der sieben vorhergehenden Stoffe. Newslands erinnert dies an die Musik und das Prinzip der Oktaven, in denen sich die Töne der Tonleiter zwar als gleicher Ton, aber mit anderer Tonhöhe wiederholen. Er tauft seine Entdeckung daher „Gesetz der Oktaven“.
Um die Parallelen noch deutlicher zu machen, sortiert Newlands seine Reihe um und ordnet die Elemente nun in Spalten von jeweils sieben Zeilen ein. In den Zeilen dieser Tabelle sammeln sich jetzt auffallend viele ähnliche Elemente. So steht Fluor neben Chlor, Brom und Iod, Magnesium neben Calcium, Strontium und Barium. Allerdings gibt es auch gewaltige Ausreißer dazwischen, wie Nickel und Palladium, die er zwischen Chlor und Iod setzt oder Silber in der Reihe von Lithium und Natrium. Ihre Elementeigenschaften weichen so stark von ihren Nachbarn ab, dass dies so nicht stimmen kann. Andere Reihen – vor allem die unterste – enthalten gleich eine wilde Mischung ganz unterschiedlicher Stoffe – von einem System oder gar Ähnlichkeiten keine Spur.
Aber warum? Newlands spürt, dass er nah dran ist, dass sein System nicht grundlegend falsch sein kann. Aber das Problem der „Ausreißer“ bekommt er nicht in den Griff. Tausende Kilometer weiter östlich jedoch nähert sich ein anderer inzwischen beharrlich der Lösung des Problems…
Nadja Podbregar
Stand: 18.02.2011







