Herbst 1911. Der junge dänische Physiker Niels Bohr hat gerade seine Doktorarbeit zur Elektronentheorie der Metalle abgeschlossen und ist auf dem Weg zu seinem großen Idol: Er darf im Rahmen eines Forschungsaufenthalts im Labor des Nobelpreisträgers und „Elektronenpapstes“ Joseph John Thomson mitarbeiten. Bereits in seiner Diplomarbeit hat sich Bohr mit der Arbeit von Thomson auseinandergesetzt – und platzt nun vor neuen Ideen und Verbesserungsvorschlägen. „Voll wildem, dummem Mut“, beschreibt er seinen Gemütszustand später.
Besuch in Manchester
Damit allerdings kommt er beim etablierten Nobelpreisträger nicht gerade gut an. Dieser nimmt den mit Akzent sprechenden Jungforscher nicht wirklich für voll und ist zudem viel zu sehr damit beschäftigt, sein Rosinenkuchen-Modell und dessen Konsequenzen weiter zu entwickeln. Bohr bleibt dennoch für rund ein halbes Jahr in Cambridge, folgt Vorlesungen und Vorträgen von Thomson, aber auch dem Mathematiker Joseph Larmor.
Im Februar 1912 dann bietet sich ihm die nächste große Chance: Er kann im Labor von Ernest Rutherford in Manchester mitarbeiten – kurze Zeit nachdem dieser sein bahnbrechendes Goldfolien-Experiment veröffentlicht hat. Bohr beschreibt seine Eindruck des Forschers so: „Ein echt erstklassiger Mann und extrem fähig, in vielerlei Hinsicht noch fähiger als Thomson, wenn auch vielleicht nicht so begabt“, so die fast schon vorwitzige Einschätzung des Jungphysikers. Und auch bei Rutherford tut Bohr zunächst das, was ihm besonders liegt: Er beschäftigt sich mit den Modellen seines Chefs und analysiert sie auf seine eigene Weise.
Deutlich getrennt: Chemie und Radioaktivität
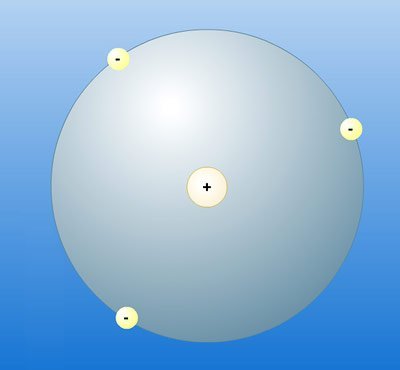
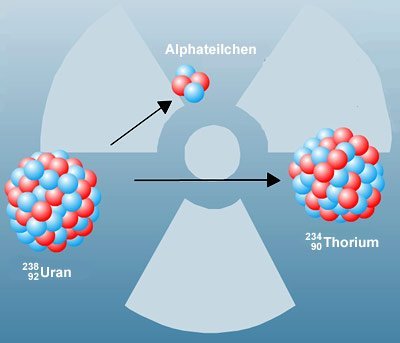
Dabei erkennt Bohr bereits, was selbst Rutherford zu diesem Zeitpunkt noch nicht bewusst ist: Das Kern-Hülle-Modell liefert auch das Handwerkszeug, um radioaktive und chemische Reaktionen klar voneinander abzugrenzen. Denn alles, das die Hülle und die darin befindlichen Elektronen beeinflusst und verändert, ist seiner Definition nach Chemie.