Mit dem Penicillin hatte der britische Mediziner und Bakteriologe Alexander Fleming die „magische Kugel“ entdeckt, eine erste wirksame Waffe gegen die Keime. Doch schon wenig später erweiterte sich dieses Waffenarsenal um weitere Mittel. Heute sind rund 8.000 antibiotisch wirkende Substanzen bekannt, in Deutschland waren im Jahr 2005 2.775 Präparate zugelassen. In der Humanmedizin eingesetzt wird davon jedoch nur ein Bruchteil, meist dominieren wenige Dutzend Standardantibiotika. In ihrer Wirkung gegen Bakterien folgen sie vier Hauptstrategien – und gegen jeden dieser Angriffspunkte haben Bakterien inzwischen eine Methode der Gegenwehr entwickelt.
Penicillin und mit ihm alle zur Gruppe der so genannten Beta-Lactame gehörenden Antibiotika stören die Zellwandbildung sich teilender Bakterien. Sie binden an so genannte „Penicillin-Bindeproteine“ (PBP), Enzyme in der Zellmembran, die für den Aufbau des stabilen Makromolekülnetzes der Bakterienwand zuständig sind und blockieren so deren Funktion. Da menschliche Zellen keine Zellwände haben, sind diese nicht betroffen.
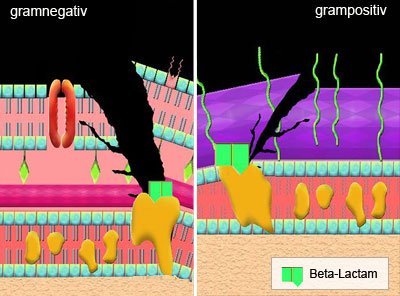
Enzym gegen Antibiotikum
Gegen diese Wirkung haben Krankheitserreger allerdings sehr schnell Gegenmaßnahmen entwickelt: Sie begannen, Enzyme zu bilden, die den aktiven Kern der Beta-Lactame, den so genannte Lactam-Ring, zerschneiden. Die Gene für diese Beta-Lactamasen sitzen häufig auf dem Plasmidring der Bakterien und sind daher leicht transferierbar. „Die Präsenz dieser Beta-Lactamase-Gene auf übertragbaren mobilen Elementen bedeutet, dass diese Gene im Prinzip jedes gramnegative Bakterium erreichen können und damit in der Zukunft eine ernsthafte Bedrohung werden können“, erklärt Cesar Arias, Leiter der Abteilung für Infektionskrankheiten an der Universität von Texas.
Neue Resistenz innerhalb von Wochen
Wie schnell dies gehen kann, zeigt der Fall eines vierjährigen Kindes in Atlanta, über das CDC-Resistenzexperte Fred Tenover 2007 berichtete. In den Blutproben des mit hohem Fieber eingelieferten Kindes fanden sich Bakterien der Art Escherichia coli, die gegen die Beta-Lactam-Antibiotika Ampicillin und klassische Cephalosporine resistent waren. Die Ärzte behandelten daher mit einer Reihe von anderen Medikamenten, darunter auch Cephalosporinen der dritten Generation. Diese Wirkstoffklasse gilt als nur wenig anfällig gegenüber bakteriellen Beta-Lactamasen.
Nach einigen Wochen fanden sich jedoch noch immer Krankheitskeime im Blut des Kindes. Zur Überraschung der Mediziner ergaben nähere Analysen, dass der Escherichia coli-Stamm innerhalb dieser kurzen Zeit einen zusätzlichen Typ von Abwehrenzymen entwickelt hatte, die nun auch die neuen Cephalosporine blockierten. Obendrein hatte der Erreger die Aktivität zweier Gene so verändert, dass ein Kanal in der äußeren Zellhülle undurchlässiger auch für andere Wirkstoffe wurde.

Ansatzstelle Ribosom
Mit den Abwehrenzymen und Kanalblockaden ist das Arsenal der bakteriellen Gegenmaßnahmen allerdings noch lange nicht erschöpft, wie die Resistenzbildung gegen eine zweite große Antibiotikaklasse zeigt. Diese Wirkstoffe, darunter bekannte Breitbandantibiotika wie Tetracyclin oder Streptomycin, setzen nicht an der Zellwand an, sondern blockieren die Proteinsynthese der Bakterien. Die Substanzen binden an eine der beiden Untereinheiten der Ribosomen, der „Proteinfabriken“ der Zelle. Dort verhindern sie entweder das Bilden von Proteinen oder führen zu Fehlern in der Abfolge der Aminosäuren und damit zu funktionsunfähigen Proteinen.
Doch auch gegen diese Strategien ließen Resistenzen nicht lange auf sich warten. Schon kurze Zeit nach Einführung dieser Substanzen Ende der 1940er Jahre registrierten Ärzte die ersten Ausfälle der zunächst so effektiven Mittel. 1953 grassierte in Japan eine Epidemie des Durchfall-Erregers Shigella dysenteriae, gegen die sich sowohl Tetracycline als auch Streptomycine als wirkungslos erwiesen. Inzwischen gibt es eine Vielzahl von Keimen, die gegen fast alle Antibiotika dieser Gruppe immun sind.
Schutzproteine und Rausschmeißer-Pumpen
Ihre Abwehr beruht dabei gleich auf mehreren unterschiedlichen Maßnahmen: Einige Erreger haben einfach die Bindungsstelle des Antibiotikums am Ribsosom verändert, so dass das Antibiotikum nicht mehr andocken kann. Andere entwickelten spezielle Schutzproteine, die beispielsweise Tetracycline aktiv vom Ribosom entfernen. Als sehr effektiv und auf breiter Linie erfolgreich erwies sich auch die Installation einer so genannten Efflux-Pumpe, eines aktiven Transportmechanismus in der Bakterienmembran, der alle eingedrungenen Antibiotikamoleküle wieder aus der Zelle hinauskatapultiert, bevor sie auch nur die geringste Chance haben, irgendwo anzudocken. Dieser Resistenzmechanismus wirkt auch gegen Antibiotika der dritten Gruppe, Substanzen, die die DNA-Synthese und damit die Vermehrung der Erreger stören.
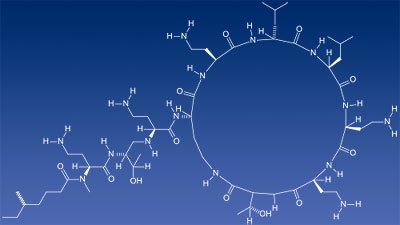
Eine Sonderrolle haben – noch – Polymyxin-Antibiotika wie Colistin. Diese großen, ringförmigen Moleküle mit einem kettenartigen Anhang reagieren mit Bestandteilen der Zellmembran der Bakterien und zerstören das Gefüge der inneren und äußeren Zellhülle gramnegativer Erreger. Die Bakterien sterben in den meisten Fällen daran.
Diese relativ neue Wirkstoffklasse hat allerdings einen extremen Nachteil: Sie schädigt auch menschliche Zellen und kann schwere Nerven- und Nierenschäden verursachen. Unter anderem deshalb wurden die Polymyxine jahrzehntelang kaum eingesetzt. Heute allerdings gehören sie – auch wegen ihres sparsamen Einsatzes – zu den wenigen Antibiotika, die auch gegen multiresistente Keime noch wirken.
Nadja Podbregar
Stand: 17.09.2010








