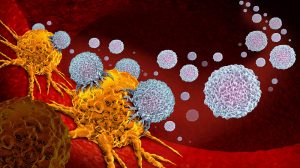
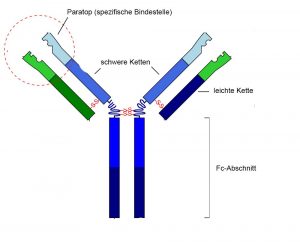
Antikörper sind ein geniales Patent unserer Immunabwehr. Diese kleinen Proteinmoleküle sind schnell in Massen herstellbar und wirken hochspezifisch: Nach dem Schlüssel-Schloss-Prinzip docken sie gezielt an bestimmten Oberflächenmolekülen von Krankheitserregern oder krankhaft veränderten Zellen an und töten sie ab. Voraussetzung dafür ist allerdings, dass das Immunsystem zuvor diese molekularen Marker identifiziert und die passenden Antikörper produziert hat.
Monoklonale Antikörper
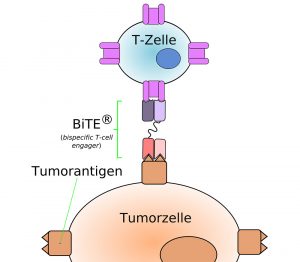
Genau an diesem Punkt setzen viele Antikörper-Therapien gegen Krebs an: Weil das Immunsystem die Tumorzellen oft nicht erkennt und daher von sich aus keine oder zu wenig Antikörper bildet, helfen Mediziner nach. Sie suchen dafür zunächst auf der Oberfläche der Krebszellen nach Antigenen, die sie von normalen Körperzellen unterscheiden und die daher spezifisch für den Krebs sind. Einige Brustkrebstumore produzieren beispielsweise vermehrt den Rezeptor HER2/neu.
Um passende Antikörper gegen diese Krebs-Antigene im Labor herzustellen, werden zunächst Mäuse mit dem Antigen „geimpft“. Ihre Immunabwehr bildet daraufhin passende Antikörper-produzierende B-Lymphozyten. Diese zellulären Antikörper-Fabriken werden in Zellkultur vermehrt und erzeugen nun große Mengen des passenden Immunglobuline, die sogenannten monoklonalen Antikörper. Krebspatienten mit dem passenden Tumortyp können dann diese Antikörper als Infusion erhalten
Einer der ersten in Deutschland zugelassenen monoklonalen Antikörper gegen Krebs ist Trastuzumab (Herceptin). Er wird gegen metastasierten Brustkrebs eingesetzt, wenn die Krebszellen den Rezeptor HER2/neu auf ihrer Oberfläche tragen – was bei etwa jeder vierten Brustkrebspatientin der Fall ist. Meist erfolgt die Antikörpertherapie dabei in Kombination mit einer klassischen Chemotherapie. Auch bei Lymphomen und Leukämie sind schon monoklonale Antikörper im Einsatz.