Normalerweise reicht die Lichtmikroskopie nicht aus, um Viren auf frischer Tat zu ertappen oder gar genauer in sie hinein zu blicken. Doch in den vergangenen Jahren wurden hinsichtlich der Auflösung der Fluoreszenzmikroskopie entscheidende Fortschritte erzielt: Wissenschaftlern ist es gelungen, die durch physikalische Gesetzmäßigkeiten limitierte Auflösungsgrenze mit eleganten Strategien zu umgehen.

Mit der STED-Mikroskopie zum Nobelpreis
Eines dieser Verfahren ist die sogenannte Stimulated Emission Depletion Mikroskopie (STED), entwickelt von Stefan Hell und seinen Mitarbeitern am Max-Planck-Institut für biophysikalische Chemie. Sie verwendeten zusätzlich zum energiereichen Lichtstrahl, der für die Anregung der Fluoreszenzmarker sorgt, einen zweiten Strahl, der die Marker wieder abregt.
Der Clou dabei: Dieser zweite Strahl ist ringförmig wie ein Doughnut. Er regt dadurch Marker aus dem Außenbereich des ersten Strahls ab und der Fluoreszenzfleck wird kleiner. Eine Auflösung von unter 20 Nanometer lässt sich auf diese Weise erreichen – mehr als das Zehnfache unter der Auflösungsgrenze der Lichtmikroskopie. Für die Entwicklung dieser bahnbrechenden Technologie hat Stefan Hell gemeinsam mit US-amerikanischen Kollegen 2014 den Nobelpreis für Chemie erhalten.

Das Virus wird bunt
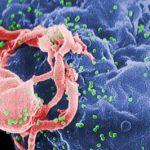
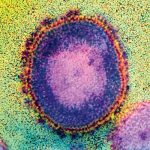
Die hochauflösende Fluoreszenzmikroskopie bildet damit eine Brücke zwischen der Licht- und der Elektronenmikroskopie. Die Auflösung ist zwar geringer als die eines Elektronenmikroskops, aber doch hoch genug, um einige Details im oder auf einem Viruspartikel darzustellen. Wie im normalen Fluoreszenzmikroskop können unterschiedliche Teile des Virus durch verschiedene Farben markiert werden, eine Einbettung der Probe in Kunststoff ist nicht nötig.
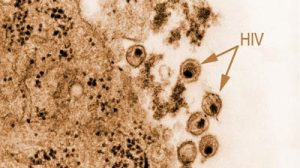
Ihre Größe etwas unterhalb der Auflösungsgrenze normaler Lichtmikroskope macht Viren zu einem idealen Studienobjekt; eine Reihe von Fragen lässt sich sehr gut mit dieser speziellen Technik beantworten. Wissenschaftler der Virologie Heidelberg untersuchten so gemeinsam mit der Arbeitsgruppe von Mike Heilemann von der Universität Frankfurt erstmals, wie sich verschiedene Membranproteine rund um entstehende HIV-Knospen verteilen. Damit lässt sich zeigen, wie das Virus seine zelluläre Umgebung nach den eigenen Bedürfnissen umgestaltet.
Versammeln zum Angriff
Auch einen überraschenden Aspekt der Virusreifung hat die hochauflösende „Superresolutions-Mikroskopie“ bereits aufgedeckt. Mitarbeiter der Virologie in Heidelberg haben zusammen mit Arbeitsgruppen von Stefan Hell aus Göttingen und Heidelberg untersucht, wie sich die äußeren
Hüllproteine verteilen. Sie vermitteln das Anheften des Virus und seinen Eintritt in die Wirtszelle.
Dabei stellte sich heraus, dass diese Proteine bei unreifen Viren über die Oberfläche des Partikels verteilt sind. Erstaunlicherweise verändert sich mit der Reifung der inneren Virusstruktur auch die Verteilung der Oberflächenproteine: Sie versammeln sich an einem Punkt, was vermutlich die bessere Eintrittseffizienz reifer Viren erklärt. Die Moleküle im Virusinneren signalisieren also offenbar der Außenseite, dass der Erreger jetzt für den Schritt ins Zellinnere bereit ist.
Barbara Müller, Universitätsklinikum Heidelberg / Ruperto Carola
Stand: 09.01.2015