In der Chemie geht es um die Wechselwirkungen zwischen Teilchen, seien es neutrale Moleküle oder Ionen, also positiv oder negativ geladene Teilchen. Und es geht um die Reaktionen der Teilchen miteinander. Dabei kommt es zu chemischen Bindungen und es entstehen neue Stoffe mit unterschiedlichen Eigenschaften.

Leichte Trennung und Sollbruchstellen
Die Wechselwirkungen zwischen den Molekülen können stark oder schwach sein, ebenso verhält es sich mit den chemischen Bindungen. Stark ist eine chemische Bindung, wenn sie von anderen Reagenzien nicht so leicht gebrochen werden kann wie eine schwache Bindung, wobei sich Bindungen gegenüber dem einen Reagenz robust und stabil verhalten können, gegenüber einem anderen wiederum nicht. Beides hat Vor- und Nachteile.
Will man etwa ein Material herstellen, das abbaubar ist, dann fügt man in dieses gezielt zahlreiche Sollbruchstellen in Form schwacher Bindungen ein. Ein Beispiel ist die sogenannte Polyhydroxyessigsäure auch Polyglycolsäure (PGA) genannt: Sie wird in der Medizin als chirurgisches Nahtmaterial verwendet und enthält zahlreiche Sollbruchstellen in Form von Esterbindungen. Unter physiologischen Bedingungen reagieren die Esterbindungen mit Wasser, und diese Reaktion sorgt dafür, dass die Wundfäden mit der Zeit in kleine, für den Körper harmlose Moleküle zerlegt werden – die Naht verschwindet scheinbar von selbst.
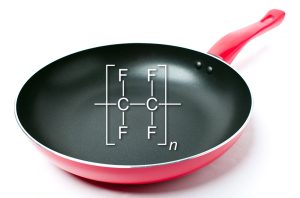
Teflon und die starken Bindungen des Fluors
Ein Beispiel für den Vorteil starker Bindungen ist die allseits bekannte Teflonpfanne, die fettfreies Braten erlaubt, weil das Bratgut nicht an der Pfanne anhaften kann. Das wird möglich, weil die Innenseite der Pfanne mit Polytetrafluorethylen beschichtet ist – das sind lange Moleküle, sogenannte Polymere, die als Basis eine Kohlenstoffkette haben. Jedes Kohlenstoffatom trägt zwei Fluoratome, an den äußeren Kohlenstoffatomen der Kettenenden sind es sogar drei.