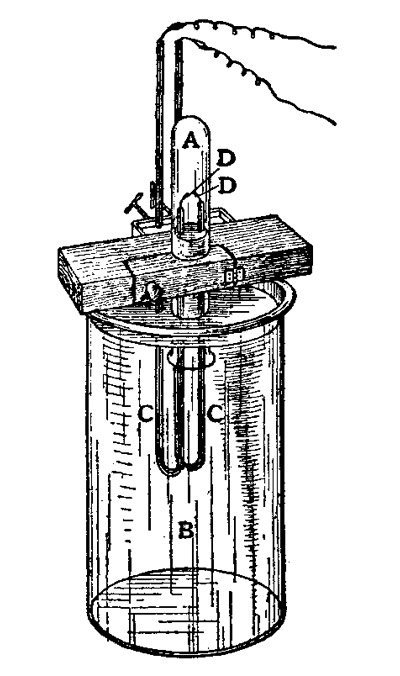
1892, ein Labor an der Universität von Cambridge in England. Der Physiker John William Strutt, Lord Rayleigh steht konzentriert über seinen Labortisch gebeugt. Vor ihm blubbert Sauerstoff durch flüssiges Ammoniak, um dann in einem rotglühenden Kupferröhrchen zu verschwinden. Am anderen Ende treten deutlich kleinere Bläschen aus. Sie enthalten das Gas, um das es Rayleigh hier geht: Stickstoff. Dieser wird freigesetzt, wenn der Sauerstoff mit Wasserstoff aus dem Ammoniak reagiert.
Schon seit einiger Zeit versucht der Wissenschaftler, die Dichte dieses Gases genauer als bisher zu messen um damit endlich das Atomgewicht des Stickstoffs herauszufinden. Um ganz sicher zu gehen, dass sich keine methodischen Fehler einschleichen, wiederholt Rayleigh den Versuch mehrfach. Er wendet zusätzlich noch eine zweite Messmethode an, bei der der Stickstoff direkt aus der Luft gewonnen wird, indem diese über glühendes Kupfer geleitet wird.
Eine rätselhafte Abweichung
„Wieder erhielt ich eine Serie von Werten in guter Übereinstimmung“, erzählt der Physiker 1904 in seinem Nobelpreis-Vortrag. „Aber zu meiner Überraschung und Verärgerung unterschieden sich die mit beiden Methoden ermittelten Dichten um ein Tausendstel – ein Unterschied, der zwar als solches gering ist, aber völlig über mögliche Messfehler hinaus geht.“ Das aus dem Ammoniak gewonnene Stickstoffgas war leichter als das aus der Luft stammende. Aber warum?
Um diese Frage zu klären, zieht Rayleigh William Ramsay hinzu, einen schottischen Chemiker, der am University College London forscht. Beide vermuten, dass der Luftstickstoff möglicherweise eine noch unbekannte Komponente enthalten könnte. Tatsächlich wird dies durch gleich zwei Versuchsansätze bestätigt: Immer bleibt eine winzige Blase aus farblosem Gas übrig, die dichter ist als Stickstoff und sich durch nichts zu einer Reaktion animieren lässt. Aber worum handelt es sich dabei? Ramsay setzt das noch junge Verfahren der Spektroskopie ein, um sich anhand der Spektrallinien – gewissermaßen des chemischen Fingerabdrucks – ein Bild zu machen.
Element ohne Raum?
Die Linien, die sich bei der Analyse des Gases zeigen, unterscheiden sich von allen bisher bekannten Elementsignaturen. Es muss sich um ein völlig neues, noch unbekanntes Element handeln. Ramsay und Rayleigh taufen das Gas „Argon“, nach dem griechischen Wort „argos“ – träge – und geben ihre Entdeckung am 31. Januar 1895 öffentlich bekannt. Nähere Untersuchungen enthüllen, dass Argon ein Atomgewicht von knapp 40 besitzt. Theoretisch müsste es daher im Periodensystem zwischen Kalium (Atomgewicht 39) und Calcium (Atomgewicht 40) einsortiert werden.
Aber zwischen Alkali- und Erdalkalimetallen ist kein Platz vorgesehen, ausgerechnet an dieser Stelle findet sich bei Mendelejew keine Lücke. Ist sein Periodensystem vielleicht doch falsch? Wenn er doch angeblich das Gesetz der Elemente verstanden hat, wie kann es dann ein Element geben, das nicht ins Schema passt?

Die Geburt einer neuen Gruppe
Die Aufregung ist groß, droht doch nichts weniger als der Umsturz der gerade erst etablierten Ordnung. Ramsay jedoch findet einen Ausweg. Er stellt fest, dass Argon eine Valenz von 0 besitzen muss, da das Gas ja mit nichts und niemandem reagieren will. Folglich passt es ohnehin nicht zwischen Kalium (Valenz 1) und Calcium (Valenz 2). Stattdessen muss es einer weiteren, noch unbekannten Gruppe im Periodensystem angehören. Ramsay stellt daher Argon hinter Chlor und beginnt damit eine achte Gruppe, die Edelgase. Weil aber im Periodensystem kein Element allein stehen kann, muss es in dieser Gruppe noch weitere Elemente geben.
Und tatsächlich erweist sich Mendelejews „Gesetz der Elemente“ wieder einmal als geradezu prophetisch: 1895 erfährt Ramsay, dass in den USA aus einem Uranmineral ein noch unbekanntes Gas isoliert worden ist und untersucht es wenig später im Spektroskop. Die Linien sind die von Helium, einem bereits zuvor in der Sonne beobachteten, aber bisher nicht näher zugeordneten Element. Ramsay belegt nun, dass auch Helium zu den Edelgasen gehört: Mit einem Atomgewicht von vier führt es fortan die Edelgasgruppe an. Wenige Jahre später entdeckt Ramsay drei weitere Edelgase, die er Neon, Krypton und Xenon tauft – die achte Gruppe füllt sich auf.
Nadja Podbregar
Stand: 18.02.2011








