Eine einzige Entdeckung hat sie berühmt gemacht: Die Mikrobiologinnen Emmanuelle Charpentier und Jennifer Doudna beschrieben mit ihrer Arbeitsgruppe im Jahr 2012 als Erste die Genschere CRISPR/ Cas9 als gentechnisches Werkzeug. Die Methode gilt aktuell als das vielversprechendste Instrument, um das Erbgut von Mensch, Tier und Pflanze zu editieren.
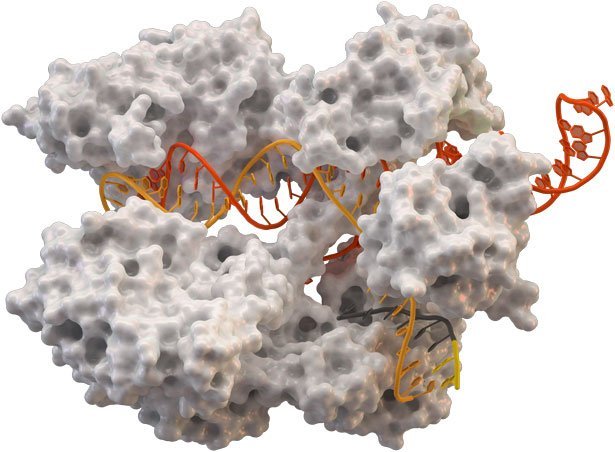
Sie macht es möglich, beliebige Genteile buchstabengenau aus der DNA herauszuschneiden und durch andere Basen zu ersetzen – so präzise wie nie zuvor. Die renommierte Fachzeitschrift „Science“ erklärte das CRISPR-Verfahren deshalb 2015 zum Durchbruch des Jahres und seine Erfinderinnen wurden bereits als heiße Nobelpreiskandidaten gehandelt. Doch wie kam es zu der Furore um einen Molekül-Komplex, der bis vor wenigen Jahren nur Experten ein Begriff war?
Raffinierte Immunantwort von Bakterien
Der Namensgeber und Hauptdarsteller der Methode ist eigentlich ein Teil des Immunsystems von Bakterien. Die Mikroorganismen wehren sich damit gegen Virenangriffe. Die CRISPR-Genabschnitte in ihrem Erbgut, sogenannte „Clustered Regularly Interspaced Short Palindromic Repeats“, besitzen zusammen mit dem Enzym Cas9 die Fähigkeit, fremde DNA-Sequenzen gezielt an eine ganz bestimmte Stelle des Erbguts einzusetzen.
Überleben die Bakterien den ersten Angriff eines unerwünschten Eindringlings, bauen sie mit diesem Mechanismus ein kurzes Stück seiner DNA in ihr Erbgut im CRISPR-Locus ein. Dieser sogenannte Spacer dient ihnen als eine Art Gen-Gedächtnis für vergangene Virenangriffe – quasi als molekulares Erinnerungsfoto des geschlagenen Feindes. Zeigt sich das dazugehörige Virus noch einmal, wird es anhand dieses „Archiveintrags“ sofort erkannt und zur Bekämpfung freigegeben.