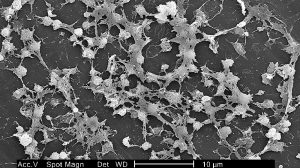
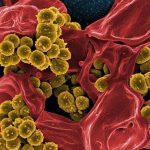
Ist der menschliche Körper einmal von Biofilm-erzeugende Krankheitserregern infiziert, ist das Immunsystem meist machtlos. Auch Antibiotika können die stabilen Bakterienkolonien innerhalb ihrer zähen Schleimmatrix kaum angreifen.
Zusammen Widerstand leisten
Der Grund: Gegenüber den Antibiotika sind Bakterien in einem Biofilm bis zu tausendfach widerstandsfähiger als einzelne Mikroben. Denn durch die Schleimschicht können kaum Stoffe passieren. Dadurch sind beispielsweise Penicilline gegen Biofilmen wirkungslos. Die Biofilm-Zellen sondern sogenannte Beta-Lactamasen ab, die die Antibiotika schneller abbauen, als sie durch Diffusion nachgeliefert werden, sodass die tieferen Zonen des Biofilms unberührt bleiben. Zudem herrschen im Inneren der Matrix Bedingungen wie ein niedriger pH-Wert, die viele Antibiotika inaktivieren.
Die Biofilm-Bewohner schützen sich auch dank ihrer Lebensweise selbst: Bakterien in Biofilmen haben meist einen langsameren Stoffwechsel und wachsen demzufolge auch nicht so schnell. Dadurch nehmen sie antibiotischen Gifte nur langsam und in geringer Dosis auf. Außerdem tragen in Biofilmen eingebundene Mikroben verglichen mit ihren frei umherschwimmenden Verwandten häufiger Resistenzgene gegen Antibiotika. Denn durch die enge Nachbarschaft kann genetisches Material zwischen Mikroben leichter ausgetauscht werden. Dabei spricht man vom horizontalen Gentransfer.
Unsterbliche Kolonien
Und selbst wenn ein therapeutischer Angriff gelingt und er einen Großteil der Bakterienkolonie im Biofilm tötet, können überlebende Mikroben schon innerhalb von 24 Stunden den Biofilm wieder neu aufbauen. Denn häufig überleben dabei vereinzelte sogenannte „Persister“, die nicht aufgrund von Antibiotika-Resistenzgenen geschützt sind, sondern durch einen anderen, nicht erblichen Schutzmechanismus.