Ein weiterer Anwendungsbereich für medizinische Hydrogele wird immer mehr das Tissue-Engineering – die Züchtung von Geweben und Organen im Labor. Solche „Retorten“-Organe könnten eines Tages, so die Hoffnung vieler Mediziner, kranke und zerstörte Organe ersetzen und Transplantationen verträglicher machen. Denn anders die ohnehin knappen Spenderorgane können solche Laborzüchtungen aus den Zellen des Patienten entstehen – eine Abstoßung wird damit verhindert.
Wachstums-Schablone für neue Organe
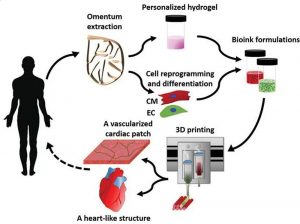
Während erste Gewebe aus einzelnen Zellen schon länger im Labor hergestellt werden können, ist die Züchtung ganzer Organe eine deutlich größere Herausforderung. Denn hier muss das komplexe Gefüge aus verschiedenen Zellen, Blutadern, Nerven und Drüsen auch in seiner dreidimensionalen Struktur dem des Organs entsprechen. Um in die richtige Form zu kommen, werden die Zellen auf Gerüsten gezüchtet, in neueren Ansätzen kommen dabei sogar 3D-Drucker zum Einsatz.
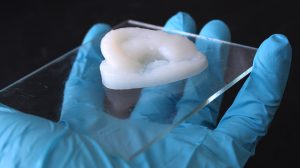
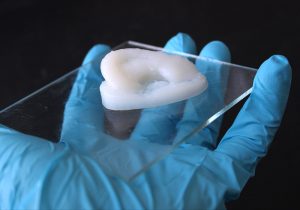
Als Gerüst für diese Organzüchtung sind Hydrogele in besonderer Weise geeignet. Denn sie können durch ihre Fähigkeit zur Wasserbindung die Zellen feucht halten und mit Nährstoffen versorgen, gleichzeitig aber geben sie durch ihre Festigkeit die Form vor. Eine Möglichkeit dafür sind Hydrogele auf Basis von Nanozellulose, einem aus Holz gewonnenen Polymer. Sie können mit einem speziellen 3D-Drucker in beliebige Form gebracht und dann ausgehärtet werden.
Dieses Grundgerüst lässt sich dann mit körpereigenen Zellen und Wirkstoffen bestücken, um biomedizinische Implantate zu erzeugen. Wenn man beispielsweise Knorpelzellen in das Gerüst integriert, können so Implantate für Menschen mit Knorpelerkrankungen oder Knorpelfehlbildungen entstehen – beispielsweise bei einer angeborenen Ohrmuschelfehlbildung oder bei Gelenkschäden. „Auch Wirkstoffe, die das Wachstum der Knorpelzellen begünstigen oder Gelenkentzündungen lindern, lassen sich in das Hydrogel einbauen“, erklärt Michael Hausmann von der Eidgenössischen Materialprüfungs- und Forschungsanstalt Empa.