Viele Forschungsgruppen in aller Welt beschäftigen sich heute mit der Organokatalyse. Kein Wunder: Anders als die meisten Metallverbindungen sind Organokatalysatoren in der Regel einfacher, lassen sich prinzipiell aus nachhaltigen Rohstoffen herstellen, sind meistens günstiger im Preis und ungiftig.
Übergangsmetalle müssen dagegen häufig unter ökologisch schwierigen Bedingungen aus ohnehin begrenzten und zum Teil schwer zugänglichen Erzvorkommen gewonnen werden. Und im besten Fall sind auch die Reaktionsbedingungen moderat. Die Aldolreaktion mit Prolin etwa verläuft in wenigen Stunden bei Raumtemperatur. Gründe genug also, möglichst viele chemische Reaktionen mithilfe organischer Katalysatoren zu beschleunigen.
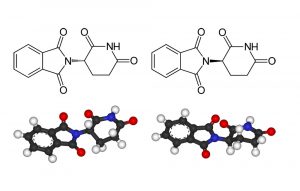
Warum „Spiegelbild“-Trennung wichtig ist
Dass sich diese prinzipiell auch für asymmetrische Katalysen eignen, hat die Forschung besonders beflügelt. Denn diese Reaktionen bereiten der Industrie häufig Kopfzerbrechen.
Gelingt eine Kontrolle der spiegelbildlichen Produkte einer Reaktion nicht, hat dies gleich zwei Nachteile. Zum einen reduziert es die Ausbeute des gewünschten Enantiomers, wenn ein Teil der Ausgangsstoffe zum unerwünschten Isomer reagiert. Zum anderen verursacht es Aufwand, Energie und Kosten, das gewünschte Enantiomer von seinem Spiegelbild abzutrennen. Hersteller sind also bestrebt, die Synthese möglichst selektiv zu gestalten.












