Bisher sind die meisten Erbkrankheiten nicht heilbar. Mediziner können allenfalls ihre Symptome mildern oder die wegen eines Gendefekts fehlenden Funktionen medikamentös ersetzen. Für die Betroffenen bedeutet dies, dass sie meist lebenslang behandelt werden müssen. Wenn sie Glück haben, reicht die Einnahme bestimmter Tabletten, in vielen Fällen sind aber auch invasivere Therapien wie Infusionen oder eine Blutwäsche nötig.
Neue Möglichkeiten dank CRISPR/Cas9
Um solche genetisch bedingten Krankheiten zu heilen, müsste man ihrer Wurzeln ansetzen: den defekten Genen oder Genabschnitten. In den letzten Jahren hat in diesem Zusammenhang vor allem eine Erfindung große Hoffnungen geweckt: die Genschere CRISPR/Cas9. Denn dieses molekularbiologische Werkzeug erlaubt es, zielgenau ererbte Gendefekte oder Mutationen in menschlichen Zellen zu reparieren – und sie macht Eingriffe in das menschliche Erbgut so einfach wie nie zuvor.
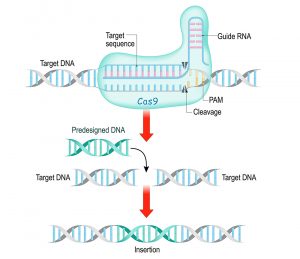
Die Genschere CRISPR/Cas9 trägt eine RNA-Kopie der DNA-Sequenz in sich, an die sie binden soll. Hat sie an der passenden Stelle des Erbgut angedockt, kommt das Enzym Ca9 zum Einsatz -die eigentliche Genschere. Sie schneidet das Genom an der vordefinierten Stelle und entfernt so die defekte Gensequenz. Je nach Verfahren wird dann die korrekte Sequenz mitgeliefert und eingefügt oder man überlässt es dem zelleigenen Reparaturverfahren, die fehlenden DNA-Basen in der korrekten Reihenfolge zu ergänzen.
Mithilfe dieses Verfahrens haben Forschungsteams inzwischen nicht nur im Tierversuch und an Zellkulturen einige Gendefekte repariert, darunter die Duchenne-Muskeldystrophie, die Sichelzellen-Anämie und einen angeborenen Hörverlust. Auch den tödlichen Gendefekt der Erbkrankheit Chorea Huntington haben Wissenschaftler an menschlichen Stammzellen bereits korrigiert. Diese Ansätze wecken die Hoffnung, solche bislang unheilbaren Erbkrankheiten bald auch bei Patienten heilen zu können.