Mit dem Beginn des 20. Jahrhunderts überschlagen sich die Ereignisse. Immer mehr Experimente liefern neue Erkenntnisse über die Bausteine der Materie – und die Physiker und Chemiker kommen kaum hinterher, entsprechende Erklärungen und Modelle für das Gefundene zu entwickeln. Vorreiter und Zentrum des Geschehens ist dabei England.
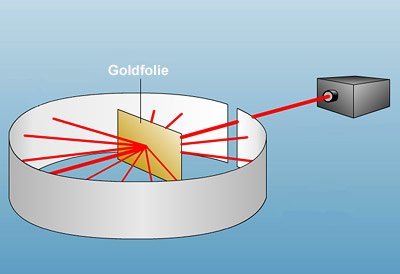
An der Universität Cambridge ist es der Physiker Joseph John Thomson, der schon kurz vor der Jahrhundertwende als erster eindeutig nachweist, dass Atome – entgegen der Vorstellungen von Dalton und Demokrit – keine massive, unteilbare Einheit sind. Es gelingt ihm zu beweisen, dass Kathodenstrahlen aus Elektronen und damit aus geladenen, subatomaren Teilchen bestehen. Seine Vermutung: Diese von der positiven Elektrode abgestrahlten Elektronen müssen aus den Atomen selbst stammen. Weil aber das Atom als Ganzes neutral ist, muss zusätzlich zu den negativ geladenen Elektronen auch noch ein positiver Rest existieren.
Wie Rosinen in einem Teig
Ausgehend von dieser Überlegung entwickelt Thomson 1903 sein „Rosinenkuchen“-Modell des Atoms: Nach diesem besteht ein Atom aus einer positiven Grundmasse, in das die Elektronen wie winzige Rosinen in einem Kuchenteig eingebettet sind. Die Elektronen, so postuliert der Forscher, können – beispielsweise im Rahmen chemischer Reaktionen – aus der Grundmasse entfernt werden.
Einem Natrium-Atom fehlt dann beispielsweise in einer Kochsalzlösung (Natriumchlorid) ein Elektron, dadurch wird es einfach positiv geladen und wandert beim Anlegen einer Spannung an den negativen Pol, die Anode. Durch dieses Modell kann Thomson die Ladungsveränderungen der Atome bei Reaktionen plausibel erklären. Tatsächlich liegt er mit seinem Grundprinzip – es werden Elektronen ausgetauscht – absolut richtig, wenn auch nicht in der Form.