Lange galten das Atom und insbesondere sein Kern als kleinste, nicht weiter zerlegbare Einheit aller Dinge: „Atomos“ – das Unteilbare. Doch inzwischen ist klar, dass der Atomkern kein Monolith, sondern aus noch kleineren Teilchen zusammengesetzt ist.
Protonen, Neutronen und die Isotope
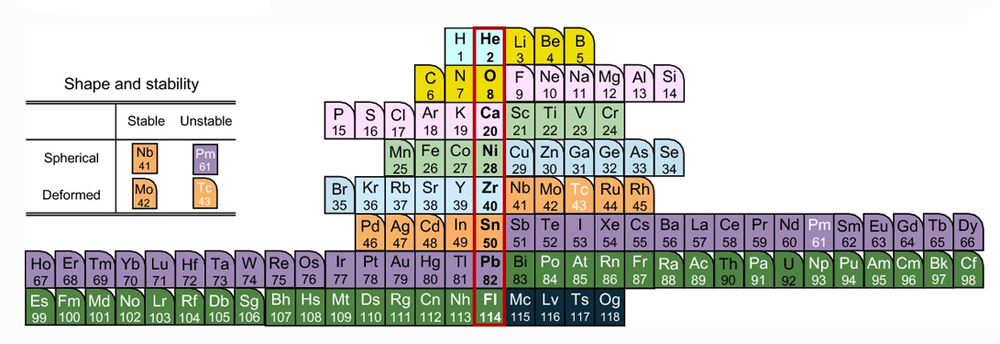
Die erste Ebene der Kernbausteine bilden die Nukleonen – positiv geladene Protonen und nicht geladene Neutronen. Beide haben etwa die gleiche Masse und prägen zusammen das Atomgewicht. Die Zahl der Protonen im Kern – auch Kernladungszahl genannt – bestimmt, wie viele Elektronen ein Atomkern an sich binden kann und zu welchem Element im Periodensystem das Atom gehört. Die Spanne reicht momentan vom leichten Wasserstoff mit nur einem Proton bis zum Organesson mit 118 Protonen – dem bisher schwersten bekannten Element.
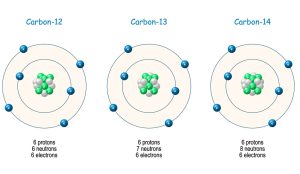
Doch nicht jeder Atomkern innerhalb eines Elements ist identisch: Bei gleicher Protonenzahl kann die Menge der Neutronen im Atomkern variieren, diese Varianten werden als Isotope bezeichnet. Beim Kohlenstoff beispielsweise haben 98,9 Prozent aller Atome sechs Protonen und sechs Neutronen im Kern. Bei 1,1 Prozent des Kohlenstoffs kommt jedoch ein siebtes Neutron dazu und bildet das Kohlenstoff-Isotop 13C. Jedes Milliardste Kohlenstoffatom hat sogar noch ein achtes Neutron. Je nach Nukleonenzahl kann ein Isotop entweder dauerhaft stabil sein oder aber nach einiger Zeit zerfallen. Während 12C und 13C stabil sind, liegt die Halbwertszeit bei 14C bei rund 5.700 Jahren.
Hat der Atomkern eine Struktur?
So weit, so bekannt. Doch wie sieht es im Inneren eines Atomkerns aus? Bilden die Nukleonen einfach nur einen ungeordneten massiven Klumpen? Oder gibt es möglicherweise eine innere Struktur? Bisher ist diese Frage nicht eindeutig beantwortet – es gibt aber Indizien für Letzteres. So beobachteten Wissenschaftler schon in den 1950er Jahren, dass Atomkerne mit einer bestimmten Zahl von Kernbausteinen stabiler sind als andere. Tragen sie eine solche „magische Zahl“ von Protonen oder Neutronen in sich, zerfallen radioaktive Isotope später und stabile Atomkerne benötigen mehr Energie, um Nukleonen abzugeben.