Bei Autoimmunerkrankungen – so lautet die derzeit allgemein akzeptierte Hypothese – kann das Immunsystem „selbst“ von „fremd“ nicht mehr unterscheiden. Die molekularen Details indes sind noch kaum verstanden. Vom Lupus erythematodes wissen wir mittlerweile, dass er mit Antikörpern einhergeht, die sich gegen Bestandteile des Zellkerns richten. Man nennt sie deshalb auch antinukleäre Antikörper.
Aber wie können diese Antikörper überhaupt entstehen? Der Kern liegt ja versteckt im Innern der Zelle, umgeben vom Zytoplasma und umschlossen von der Zellmembran. Wie kommen die im Blut zirkulierenden Akteure des Immunsystems in Kontakt mit Zellkernen und ihren Bestandteilen?
Zell-Selbstmord mit Nachwirkungen
Die Erklärung liefert ein Phänomen, das natürlicherweise ständig in unserem Körper stattfindet und Apoptose, programmierter Zelltod, genannt wird. Während der Apoptose sterben Zellen nach einem festen Programm kontrolliert ab. Während die Zellen zugrunde gehen, werden auch Bestandteile des Zellkerns frei. Der gesunde Organismus entfernt die Reste apoptotisch sterbender Zellen sehr schnell und vollständig: Dafür sind weitere wichtige Akteure des Immunsystems, die Fresszellen, zuständig.
Die Untersuchungen der Heidelberger Forscher belegen, dass dieser Vorgang bei etwa einem Drittel der Patienten, die an Lupus erythematodes erkrankt sind, nicht gut genug funktioniert. Aus Untersuchungen mit Tieren ist bekannt, dass übriog bleibende Zellkernreste apoptotisch sterbender Zellen zu Symptomen führt, die dem Lupus erythematodes des Menschen ähneln.
Mikrovesikel mit Antigenen
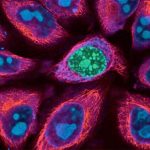
Wenn die Zelle durch Apoptose stirbt, werden Bestandteile des Zellkerns in kleine Bläschen verpackt und aus der Zelle ausgeschleust. Diese apoptotischen Mikrovesikel – die frühen Abbauprodukte der sterbenden Zelle – enthalten nahezu alle Antigene, die typisch für den Lupus erythematodes sind. Darüber hinaus zeigte sich, dass Antigen-präsentierende Zellen von den Mikrovesikeln in besonderer Weise stimuliert werden.

In der Folge führt dies zur Freisetzung von Interferon alpha: Dieser immunstimulierende Botenstoff ist einer der Serummarker, der die Entzündungsaktivität des Lupus erythematodes am besten widerspiegelt. Das Immunsystem des gesunden Organismus kann auf die Mikrovesikel nicht aufmerksam werden, weil die Fresszellen sie schnell und rückstandslos beseitigen. Die Forscher stellten fest, dass sich die HLA-Moleküle auf den Fresszellen verändern, wenn sie Mikrovesikel aufgenommen haben. Bei Patienten mit aktivem Lupus erythematodes aber funktioniert die Modulation der HLA-Moleküle nicht mehr – und dies korreliert in frappanter Weise mit der Krankheitsaktivität.
Ungenügende Müllabfuhr schuld?
Die Hypothese zur Krankheitsentstehung, die die Forscher auf der Basis ihrer Arbeiten aufstellen, lautet: Abfallprodukte menschlicher Zellen, wie sie jeden Tag im Körper millionenfach anfallen, können Akteure des Immunsystems auf den Plan rufen – wenn die „Müllabfuhr“ nicht funktioniert. Im Falle des Lupus erythematodes sind die Abfallprodukte Bestandteile des Zellkerns. Sie werden während der natürlicherweise stattfindenden Apoptose nicht ordnungsgerecht entsorgt. Dies provoziert Abwehrreaktionen des Immunsystems.
In der Kette der Ereignisse bilden sich Antikörper, die sich gegen die körpereigenen Strukturen richten. Die über ihr eigentliches Ziel – die Abwehr körperfremder Eindringlinge – hinausschießende Immunreaktion äußert sich mit den entzündlichen Symptomen des Lupus erythematodes. In künftigen Arbeiten wollen die Wissenschaftler klären, wie die bislang ursächlich nicht behandelbare Autoimmunerkrankung auf der Grundlage der neuen molekularen Erkenntnisse besser therapiert, womöglich sogar geheilt werden kann.
Hanns-Martin Lorenz, Universitätsklinikum Heidelberg / Ruperto Carola
Stand: 23.05.2014