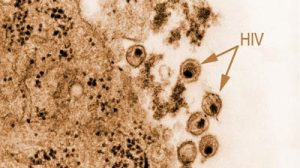
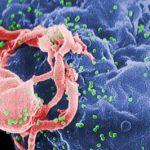
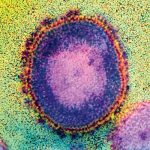
Obwohl wir diese Vorgänge, die von zentraler Bedeutung für die HIV-Vermehrung sind, in ihren Grundzügen bereits seit vielen Jahren kennen, sind noch viele Fragen offen. Die Umlagerung einer geordneten Struktur in eine völlig andere geordnete Struktur im Inneren eines winzigen Viruspartikels ist sehr kompliziert.
Man kann sich das in etwa so vorstellen, als müssten Autofahrer ihre Wagen in einem voll besetzten Parkhaus nach Karosseriefarbe sortiert umparken. Das kann nicht funktionieren, wenn alle planlos auf engem Raum durcheinander irren. Stattdessen muss ein sorgsam koordiniertes Ballett von Einzelschritten ablaufen – und das geschieht offensichtlich auch.
Die Dynamik ist entscheidend
Außerdem muss die Virusreifung genau zum richtigen Zeitpunkt beginnen. Spaltet die Protease das Gag-Protein schon vor der Virusfreisetzung, zerfällt das entstehende Virus noch in der Ursprungszelle in seine Bestandteile; erfolgt die Spaltung dagegen zu spät, ist das Virus nicht bereit, wenn es auf
seine nächste Wirtszelle trifft. Die Virusreifung muss also streng reguliert und kontrolliert werden – nur wie?
Experimente haben gezeigt, dass schon subtile Störungen – zum Beispiel eine geringfügig erniedrigte oder erhöhte Protease-Aktivität – den sorgfältig ausbalancierten Mechanismus zum Kippen bringen und damit das Entstehen infektiöser HI-Viren verhindern kann. Entscheidend ist die Kontrolle der Dynamik des Vorgangs.
Schnappschüsse reichen nicht
Aber auf Fragen wie: „Wann und wodurch wird der Reifungsprozess ausgelöst? Wie lange dauert er? Wie finden alle Einzelteile an ihren richtigen Platz?“ haben wir keine Antwort. Den Aufbau des unreifen und des reifen HI-Virus konnten Forscher im Labor von John Briggs vom Europäischen Laboratorium für Molekularbiologie (EMBL) in Heidelberg mithilfe der Kryo-Elektronenmikroskopie zwar bis ins Detail beschreiben – was aber dazwischen geschieht, ist rätselhaft.
Ein Grund dafür: Die Eigenschaften des Virus machen es schwierig, diese Fragen zu untersuchen. Zum einen sind Viren sehr klein und bleiben deshalb in normalen Lichtmikroskopen unsichtbar. Mit Elektronenmikroskopen können wir sie zwar erkennen, aber dazu müssen die Partikel eingefroren oder in Plastikmaterial eingebettet werden. Damit sind also nur „Schnappschüsse“ möglich – dynamische Vorgänge wie Umlagerungen während des Reifens der Viren lassen sich nicht beobachten.
Jedes Virus tickt anders
Zum anderen bildet eine infizierte Zelle Tausende von Viruspartikeln. Das geschieht aber nicht synchron, sondern jedes einzelne Virus folgt seinem eigenen Zeitplan. Wenn wir also im Labor die Bildung von HI-Viren in einer Kulturschale voller Wirtszellen verfolgen, beobachten wir zu jedem Zeitpunkt viele Millionen einzelner Viren, die sich in unterschiedlichen Stadien ihres Lebenszyklus befinden.
Analysieren wir dann alle Partikel gemeinsam mit biochemischen Untersuchungsmethoden oder mit der Elektronenmikroskopie, erhalten wir zwar Informationen über den durchschnittlichen Zustand – Informationen über einzelne Schritte aber gehen verloren. Diese beiden grundsätzlichen Probleme waren lange Zeit nicht lösbar.
Barbara Müller, Universitätsklinikum Heidelberg / Ruperto Carola
Stand: 09.01.2015