Wenn es um die Konstruktion maßgeschneiderter Moleküle geht, arbeiten Chemiker nicht nur an einfachen geometrischen Formen wie Ringen oder Würfeln. Für viele Anwendungen sind auch miteinander verbundene oder ineinander verschachtelte Formen nötig.

Eine Frage der Energie
Kann man beispielsweise zwei molekulare Würfel ineinander verschachteln? Für eine solche Verschachtelung gibt es drei Möglichkeiten: über die Kanten, über die Ecken oder über die Flächen. Damit zwei intakte Würfel miteinander verschachtelt werden können, müssen daher Ecken oder Kanten entfernt, die Fragmente ineinandergeschoben und anschließend die Ecken oder Kanten wieder geschlossen werden. Auf molekularer Ebene geht das nur dann, wenn die Bindungen zwischen den Ecken- und Kanteneinheiten relativ schwach sind.
Aber warum sollten sich zwei oder gar mehrere Würfel freiwillig miteinander verschachteln? Wenn etwas in der Chemie freiwillig erfolgt, dann stets um den Preis, dass dabei Energie frei wird. Das ist genau dann der Fall, wenn die energetische Gesamtsituation nach der Reaktion günstiger ist als vor der Reaktion.
Gulliver und die Liliput-Fesseln
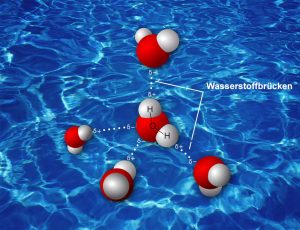
Doch um die Frage zu beantworten, muss man außerdem noch wissen, dass es neben den echten und gerichteten Bindungen innerhalb von Molekülen noch weitere, deutlich schwächere intermolekulare Wechselwirkungen gibt, beispielsweise Wasserstoffbrückenbindungen oder die noch schwächeren Dispersionswechselwirkungen. Jede Wasserstoffbrücke oder Dispersionswechselwirkung ist für sich allein genommen sehr schwach – treten sie aber gemeinsam und in Vielzahl auf, ändert sich das.