Die Faltung eines Proteins beginnt mit einfachen Bindungen der Wasserstoffatome im Proteinrückgrat und wird schnell kompliziert, wenn es um die Interaktion von Seitenketten der Aminosäuren geht. Doch das Verständnis dieser grundlegenden Mechanismen ist wichtig um die Relevanz einer korrekten Faltung nachvollziehen zu können.
Von der DNA zum funktionstüchtigen Protein
Für die Herstellung eines Proteins wird zunächst der Abschnitt der DNA, der für ein bestimmtes Protein codiert, im Zellkern unserer menschlichen Zellen von der DNA-Polymerase abgelesen und in mRNA umgeschrieben. Diese Messenger-RNA ist eine Kopie der DNA, welche die Information der Bauanleitung für die Proteine aus dem Zellkern in das Zellplasma transportiert. Im Zellplasma warten schon die Ribosomen, welche die mRNA auslesen und entsprechend dieser Bauanleitung verschiedene Aminosäuren in einer ganz bestimmten Reihenfolge zu einer Kette verknüpfen und damit das Protein herstellen.
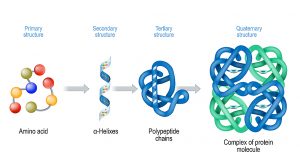
Ein normales Protein wird durch die Aneinanderreihung von etwa 100 – 300 Aminosäuren gebildet. Dafür stehen zwanzig verschiedene Aminosäuren zur Verfügung, die jeweils anders aufgebaut sind und unterschiedliche spezifische Funktionen für das Protein erfüllen können. Diese Funktionen können sie aber erst ausüben, nachdem sie die korrekte räumliche Anordnung eingenommen haben. Der dafür notwendige Faltungsprozess findet ebenfalls im Zellplasma statt, noch während die Aminosäurekette noch am Ribosom synthetisiert wird.
Zuerst interagieren die Moleküle im Proteinrückgrat
Die 3D-Struktur von Proteinen setzt sich aus mehreren Strukturebenen zusammen, die Schicht für Schicht gebildet werden. Am Anfang steht dabei die Aminosäurekette, welche die Primärstruktur bildet. Die Aminosäuren sind miteinander über spezielle Bindungen verknüpft, die im fertigen Protein das sogenannte „Rückgrat“ bilden.