Während sich Einstein und Planck mit der merkwürdig gequantelten Natur von elektromagnetischer Strahlung herumschlagen, kämpfen Physiker auch in einem anderen Gebiet mit schwer erklärbaren Phänomenen.
Das Rätsel der Spektrallinien
Im Mittelpunkt des Rätsels stehen die um 1850 von Joseph von Fraunhofer entdeckten Spektrallinien und ihre Interpretation durch die Chemiker Robert Bunsen und Gustav Kirchhoff im Jahr 1860. Seither ist bekannt, dass der „Strichcode“ des Lichtspektrums elementspezifisch ist und irgendwie mit der Beschaffenheit der verschiedenen Atome zusammenhängen muss. So erzeugt beispielsweise Wasserstoff bei Energiezufuhr Spektrallinien nur bei bestimmten Wellenlängen. Je nach Energiezugabe bilden diese Linien Serien – die Balmer-Serie, die Lyman-Serie und die Paschen-Serie. Doch warum, bleibt unklar.

An diesem Punkt kommt ein weiterer Pionier des Quantenzeitalters ins Spiel: Niels Bohr. Der junge dänische Physiker arbeitet zu diesem Zeitpunkt im Labor von Ernest Rutherford, der als erster die Trennung von Atomkern und Elektronenhülle bewiesen hat. Doch Rutherfords Atommodell kann nicht erklären, warum die Atome bei Anregung immer nur Licht bestimmter Wellenlängen abgeben. Bohr hat sich jedoch mit dem von Planck und Einstein entdeckten Phänomen der gequantelten Strahlung beschäftigt. Er versucht daher, das Atommodell so weiterzuentwickeln, dass es dieses Phänomen erklären kann.
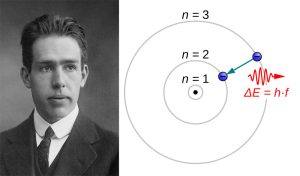
Bohr und die „gequantelten“ Elektronenbahnen
Und es funktioniert: 1913 veröffentlicht Niels Bohr sein bahnbrechendes Atommodell. „Bohrs entscheidende Erkenntnis war, dass Elektronen nur spezifische, stationäre Bahnen um den Kern einnehmen können“, erklärt der Physiker Oliver Passon von der Universität Wuppertal. „In gewisser Weise sind auch sie damit gequantelt.“ Wird dem Atom Energie zugeführt, springen die Elektronen vorübergehend auf eine nächsthöhere Bahn, geben diese Energie aber wenig später wieder als Licht ab.













